Diagnóstico y tratamiento de las lesiones intraepiteliales escamosas de alto grado del cuello uterino
Diagnóstico y tratamiento de las lesiones intraepiteliales escamosas de alto grado del cuello uterino |
INTRODUCCIÓN. El cáncer cérvico-uterino tiene una fase precursora de larga duración, pues debe pasar por varios estados previos al cáncer invasivo, denominados lesiones intraepiteliales, de bajo y de alto grado, que pueden transformarse en lesiones malignas. La importancia de un diagnóstico oportuno y certero de las lesiones intraepiteliales escamosas de alto grado radica en que, si son tratadas de manera oportuna, son ciento por ciento curables. OBJETIVO. Proporcionar información actualizada sobre el diagnóstico y tratamiento de las lesiones precursoras de cáncer de cérvix y ayudar a los profesionales en la toma de decisiones médicas. MATERIALES Y MÉTODOS. Estudio de revisión de 45 artículos científicos la gran mayoría de la última década y, unos pocos, con datos históricos vigentes sobre lesiones intraepiteliales escamosas de alto grado del cuello uterino. La búsqueda se realizó en MedLine, PLoS y Scielo utilizando los términos tamizaje, neoplasias uterinas, lesiones intraepiteliales escamosas de cuello uterino y tratamiento. RESULTADOS. Los artículos científicos fueron seleccionados por niveles de evidencia 1 y 2, con recomendaciones A y B. Las recomendaciones de inicio de tamizaje han cambiado y el manejo toma en cuenta el riesgo acumulado por tipo de lesión. El tratamiento, en la mayoría de casos, es la escisión y resulta definitivo. CONCLUSIÓN. El diagnóstico sigue siendo cito-colpo-histológico y el tratamiento depende de la edad de la paciente, pudiendo las posibilidades ir de la observación hasta la escisión quirúrgica y, en casos específicos, la histerectomía.
Palabras Clave: Diagnóstico; Lesiones Intraepiteliales Escamosas del Cuello Uterino; Neoplasias Uterinas; Tamizaje Masivo; Colposcopía; Conización.
INTRODUCTION. Cervical-uterine cancer has a long-term precursor phase, as it
must go through several states prior to invasive cancer, called intraepithelial lesions,
low and high grade, which can become malignant lesions. The importance of a
timely and accurate diagnosis of high-grade squamous intraepithelial lesions is that,
if treated in a timely manner, they are one hundred percent curable. OBJECTIVE.
Provide updated information on the diagnosis and treatment of precursor lesions of
cervical cancer and assist professionals in medical decision making. MATERIALS
AND METHODS. Review study of 45 scientific articles the vast majority of the last
decade and, a few, with current historical data on high-grade squamous intraepithelial
lesions of the cervix. The search was conducted in MedLine, PLoS and Scielo using
the terms screening, uterine neoplasms, squamous intraepithelial lesions of the cervix
and treatment. RESULTS. The scientific articles were selected by levels of evidence
1 and 2, with recommendations A and B. The recommendations for starting screening
have changed and management takes into account the accumulated risk by type of
injury. The treatment, in most cases, is excision and is definitive. CONCLUSION. The
diagnosis is still cyto-histological and the treatment depends on the age of the patient,
and the possibilities may range from observation to surgical excision and, in specific
cases, hysterectomy.
Keywords: Diagnosis; Squamous Intraepithelial Lesions of the Cervix; Uterine Neoplasms; Mass Screening; Colposcopy; Conization.
Las lesiones intraepiteliales constituyen una gama de alteraciones celulares del epitelio escamoso del cuello uterino que, de no tratarse, pueden llevar al cáncer1. Los cambios se desencadenan por una infección persistente por papiloma virus humano (PVH) de alto riesgo2. El cáncer cérvico-uterino es uno de los pocos cánceres con una fase precursora de larga duración, brindando amplias oportunidades para tamizaje con diagnóstico oportuno y tratamiento curativo certero, pero las pacientes deben tener adecuada información sobre la importancia de su realización y se debe aumentar su cobertura3. Las lesiones intraepiteliales pueden ser de bajo grado (LIEBG) y de alto grado (LIEAG), la denominación se da por el menor o mayor riesgo de evolución hacia carcinoma in situ y carcinoma invasor. El consenso de Bethesda en 2012 y los datos de casi 1,4 millones de mujeres en el “The Kaiser Permanente Northern California Medical Care”, presentaron datos sobre el riesgo después de pruebas anormales de citología y detección de PVH. La mayoría de recomendaciones se ratificaron y solo unos pocos cambios se incluyeron, entre otros, el manejo menos invasivo en mujeres entre 21 y 24 años, en especial para anomalías menores y también en resultados con presencia de células escamosas atípicas y genotipificación para PVH negativo, debe realizarse las dos pruebas en tres años4.
La prevalencia de PVH de alto riesgo se relaciona con la tasa de incidencia del cáncer de cuello uterino. Una meta-análisis realizada en China con 30207 mujeres en 17 estudios, reportó una prevalencia de 17,7% de PVH de alto riesgo5. La prevalencia en Quito-Ecuador 2014, en un estudio realizado en el Hospital de Especialidades Carlos Andrade Marín con 10011 especímenes, fue de 11,9% con 2,1% para el tipo 16,0 y 0,6% para el 186. La detección de lesiones intraepiteliales escamosas de alto grado debe llevar a un tratamiento eficaz y el seguimiento se lo debe realizar de acuerdo con guías de práctica clínica apropiadas.
Aportar en el conocimiento del manejo actual de las lesiones intraepiteliales escamosas de alto grado del cuello uterino y ayudar a los profesionales en la toma de decisiones médicas, para lo cual se realizó búsquedas bibliográficas en bases como Medline, PloS y Scielo en especial desde el año 2000.
El término clásico de Neoplasia Intra Cervical (NIC) se corresponde con la displasia como sigue: NIC 1-displasia leve, con células displásicas que ocupan el tercio inferior del epitelio escamoso; NIC 2-displasia moderada, en que las células displásicas ocupan hasta los dos tercios del epitelio; NIC 3-displasia severa, con células displásicas presentes en más de los dos tercios del epitelio.
En 1988 se introdujo el Sistema Bethesda para la nomenclatura de la citología cérvico vaginal, mismo que ha sido revisado en 1991 y 20017. La revisión del 2001 al Sistema Bethesda elimina la categoría de “satisfactorio pero limitado”, divide el término ASC-US, reemplaza AGUS por AGC (células glandulares atípicas). El sistema se resume así: LIEBG (lesión intraepitelial de bajo grado) incluye NIC 1, atipia coilocítica; LIEAG (lesión intraepitelial de alto grado) lo conforman NIC 2, NIC 3 y CIS (carcinoma in situ). El término ASC-US (atipia de células escamosas de importancia indeterminada) se divide en ASC-US (atipia de significado indeterminado) y en ASC-H (no se puede excluir lesión de alto grado). AGUS (células glandulares atípicas de sig- nificado indeterminado), se reemplaza por AGC (células glandulares atípicas) porque las células atípicas pueden presentarse en lesiones graves8.
La terminología LAST (Lower Anogenital Squamous Terminology) publicada por el Colegio Americano de Patología y la Sociedad Americana de Colposcopía y Patología Cervical, utiliza terminología del cuello uterino, así: NIC 1 se conoce como LIEBG; NIC 2 se clasifica, según la inmunotinción p16 para identificar células con alta probabilidad de ser cancerosas, si es negativa será LIEBG y si es positiva LIEAG: NIC 3 se denomina LIEAG9,10.
Un estudio de cohorte observacional a 5 años realizado en Portland en 150052 mujeres, reportó una tasa de citologías anormales de 14,9 x 1000, la incidencia de Neoplasia Intraepitelial Cervical -NIC 1 fue de 1,2 x 1000 con pico entre 20 a 24 años de edad (5,1 x 1000); la incidencia de NIC 2/3 fue de 1,5 x 1000, con la tasa más alta en mujeres de 25 a 29 años (8,1x1000). En 44493 citologías de rutina se encontró 0,3% de lesiones de alto grado y un 0,02% de cáncer, en el seguimiento se encontraron porcentajes para NIC 1 de 8,1%, para NIC 2 de 5,8%, para NIC 3 de 4,9% y para cáncer invasor de 0,6%11.
Katki12 y colaboradores en un estudio con seguimiento a 5 años con una muestra de 965360 mujeres entre 30 y 64 años, encontró una prevalencia para LIEAG de 0,21%. Tabla 1.
| Resultados | Porcentaje % |
|||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Fuente. Katki HA, Schiffman M, Castle PE, et al12. Elaborado por. Autor | ||||||||||
| Negativo | 96 |
|||||||||
| ASC-US | 2,8 |
|||||||||
| LIEBG | 0,97 |
|||||||||
| LIEAG | 0,21 |
|||||||||
| AGUS | 0,21 |
|||||||||
| ASC-H | 0,17 |
|||||||||
| Carcinoma escamo celular | 4,5 x 100000 |
|||||||||
| N | 965 360 |
|||||||||
El principal factor de riesgo para lesiones intraepiteliales y cáncer de cuello uterino es la infección persistente por tipos de virus de papiloma de alto riesgo, en especial los tipos 16 y 18 que están presentes en 70,0% de cánceres de cuello uterino13. Al parecer existe una distribución geográfica del virus, en Madagascar, isla del África, los datos fueron: HPV -53 (6,2%) y HPV-68 (5,8%), seguido por HPV -52 (5,2%), HPV -35 (4,5%), HPV -73 (3,4%), HPV -31 (3,4%), HPV -16 (3,1%), y HPV-18 (3,1%); el 25,8% de los casos de NIC 2 se asoció a VPH 16/1814. Cabe anotar que la infección en mujeres jóvenes es de corta duración, por lo cual en este tipo poblacional se recomienda solo la observación y el seguimiento15.
Otro factor de riesgo es la falta de adherencia al tamizaje. Las mujeres que desarrollan cáncer invasor del cuello uterino tienen una detección o tamizaje sub-óptimo, muchas nunca se sometieron a una citología o la última se realizó más de 5 años antes16.
Otros factores son el inicio temprano de la actividad sexual, múltiples parejas sexuales, pareja sexual de riesgo, antecedentes de infecciones de transmisión sexual, neoplasia intravulvar VIN), neoplasia intravaginal (VAIN) y la inmunosupresión17.
La Organización Mundial de la Salud (OMS) reconoce tres pruebas para tamizaje de cáncer de cuello uterino: citología, detección de PVH e inspección visual directa con ácido acético (IVAA).
El tamizaje del cáncer del cuello uterino mediante citología ha tenido gran impacto en la reducción de la enfermedad invasiva y el aumento del diagnóstico de las lesiones intraepiteliales y de cáncer in situ. En Inglaterra, entre 1988 y 1994, se duplicó la cobertura de citología alcanzando un 85,0% y la incidencia del carcinoma invasor se redujo en 35,0%18. Varios estudios han demostrado la disminución de la tasa de cáncer uterino y su mortalidad mediante el aumento de cobertura de la citología convencional con programas de tamizaje, ejemplos son la disminución en 35,0% en Gales19, entre 41,0%-49,0% en países nórdicos20 y 50,0% de la mortalidad en Japón21.
Las recomendaciones para tamizaje de la OMS se resumen como sigue: no empezar antes de los 30 años de edad; realizar por lo menos una vez a mujeres entre 30 y 49 años; pacientes con tamizaje positivo deben ser tratadas de manera eficaz; se recomienda tamizaje-tratamiento o bien tamizaje-diagnóstico y tratamiento, dentro de la conducta de “Ver y Tratar”; si los resultados de citología e IVAA (inspección visual con ácido acético) son negativos, el próximo control se realizará en 3 a 5 años; si la detección de PVH de alto riesgo es negativa, se aconseja control en 5 años; ante la sospecha de cáncer se debe derivar “NO tratar”; ante resultado positivo de tamizaje, crioterapia y LEEP son opciones de tratamiento22.
El tamizaje también se realiza mediante identificación del tipo de Papilomavirus de alto riesgo23. Los virus de alto riesgo son los 16-18-31-33-35-39-45-51-52-56-58-59-68-69 y 82; y, los de bajo riesgo son los 6-11-40-42-43-44-54-61-72-8123.
Las siguientes son algunas recomendaciones para detección de papilomavirus de acuerdo a la evidencia disponible: PVH (genotipificación) + citología llegan a 96,0% de sensibilidad para NIC 2/3 y cáncer; no se recomienda para tamizaje primario en mujeres menores de 30 años por la elevada prevalencia de la infección y alta tasa de remisión espontánea; es útil cuando la citología reporta ASC-US; es recomendable para seguimiento en ASC-US y PVH positivo; se aconseja para el seguimiento de casos tratados (alternativa a colposcopía y/o citología); utilizada de manera correcta, puede reducir la morbilidad y mortalidad de manera rentable; cuando la citología y PVH son negativos en mujeres mayores de 30 años, el tamizaje puede repetirse cada 3 a 5 años24,25.
La Sociedad Americana del Cáncer (ACS) recomienda el inicio del screening a los 21 años. Entre los 21 y 29 años recomienda citología cada 3 años; entre los 30 y 65 años se recomienda detección de PVH y citología cada 5 años, siendo aceptable también citología sola cada 3 años. El tamizaje se suspende para mujeres mayores de 65 años si la historia es negativa para lesiones intraepiteliales. No se aconseja en pacientes histerectomizadas y, en mujeres vacunadas para PVH, la recomendación es la misma que para las no vacunadas26. La Sociedad Americana de Clínica Oncológica en publicación reciente recomienda realizar el tamizaje con test de ADN para papilomavirus humano desde los 25 a los 65 años cada 5 años, si dos exámenes resultan negativos, el siguiente se puede realizar después de 10 años27.
La inspección visual con ácido acético (IVAA) y con yodo (IVI) da resultados inmediatos. Se usan para la detección del cáncer de cuello uterino en mujeres de entornos con escasos recursos que no tienen acceso a citología cervical y pruebas de virus del papiloma humano. Un 85,0% de cáncer de cérvix uterino se producen en países pobres28. Se aconseja la prueba con ácido acético, el cual deshidrata las células y al ser aplicado en células displásicas, éstas reflejan la luz y se ven áreas de color blanco (prueba positiva). El uso de la prueba de IVAA seguida del tratamiento reduce la tasa de cáncer cervical en compa-ración con la prueba de detección sola, esto se pudo comprobar en dos grandes ensayos realizados en La India en los que se concluye que la IVAA seguida de tratamiento (crioterapia) realizada bajo control de calidad por personal de salud, no solo médicos, es un método eficaz para prevenir el cáncer cervical en países en desarrollo29,30.
La citología, sea convencional o en base líquida y capa delgada, es en la actualidad la forma más común de detección del cáncer cérvicouterino. Se debe iniciar entre los 21 y 25 años o 3 años después del inicio de la vida sexual (Federación Internacional de Gineco Obstetricia). Las pruebas de VPH son las más sensibles para diagnóstico de NIC 2/3 y cáncer uterino pero, la especificidad no óptima puede hacer que muchas mujeres deban ser sometidas a estudios adicionales sin ser necesario31. Se ha propuesto la técnica de detección de VPH de alto riesgo en orina, que daría resultados inmediatos y que reportó una sensibilidad de 73,0% y especificidad de 88,0% en un meta-análisis de 14 estudios con 1440 mujeres; sin embargo, la sensibilidad es baja32.
La colposcopía ha tenido una evolución importante en las últimas décadas, el monocolposcopio de Hinselmann ha dado paso a sistemas de videocolposcopía con programas computarizados e imágenes de alta definición. Figura 1.La colposcopía se realiza para identificar lesiones precancerosas y cancerosas en los casos en que las pruebas de detección son anormales o cuando se visualizan lesiones sospechosas de manera directa. Los informes se realizan con la nueva nomenclatura de la Federación Internacional de Patología Cervical y Colposcopía (IFCPC)33, que se describe a continuación.

Evaluación general
Adecuada/Inadecuada a causa de (Ej. cuello uterino no claro por inflamación, sangrado, cicatriz). Visibilidad de la unión escamo celular: visible en su totalidad, visible en parte, no visible. Tipos de zona de transformación: 1, 2, 3.
Hallazgos colposcópicos normales
Epitelio escamoso original, maduro, atrófico, epitelio columnar, ectopia, epitelio escamoso metaplásico, quistes de Naboth, aberturas glandulares y/o criptas glandulares, deciduosis en el embarazo.
Hallazgos colposcópicos anormales
Ubicación de la lesión dentro o fuera de la zona de transformación, localización según las agujas del reloj, número de cuadrantes del cuello que cubre la lesión, tamaño de la lesión en porcentajes que abarca del cuello uterino.
Grado 1 (Menor): epitelio acetoblanco delgado, borde irregular; mosaico fino; puntillado fino.
Grado 2 (Mayor): epitelio acetoblanco denso, aparición rápida del epitelio acetoblanco; orificios glandulares abiertos con bordes engrosados; mosaico grueso; puntillado grueso; bordes delimitados; signo del límite de borde interno; signo de cresta o sobreelevado.
Hallazgos no específicos
Leucoplasia (queratosis, hiperqueratosis), erosión. Solución de lugol (test de Schiller) positivo/negativo.
Sospecha de invasión
Vasos atípicos, vasos delgados, superficie irregular, lesión exofítica, necrosis, ulceración (necrótica), tumoración nodular.
Hallazgos varios
Zona de transformación congénita, condiloma, pólipo (exocervical/endocervical), inflamación, estenosis, anomalía congénita, anomalías post tratamiento, endometriosis.
Tratamiento de escisión
Tipo de escisión (1, 2, 3), medidas de la muestra de escisión (largo, distancia del margen distal/externo al margen proximal/interno), grosor (distancia del margen estromal a la superficie de la muestra extirpada), circunferencia (opcional) y el perímetro de la muestra extirpada.
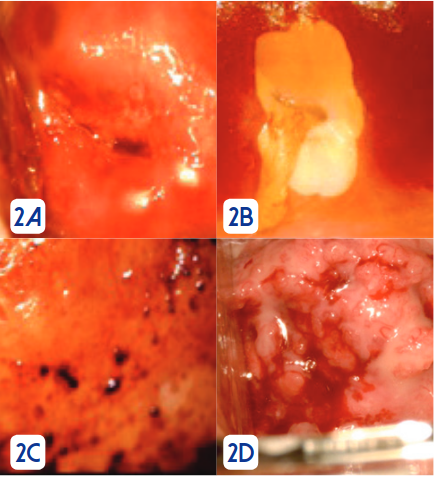
Se presentan a continuación ejemplos de imágenes colposcópicas.El diagnóstico definitivo se hace con el estudio histopatológico de la muestra tomada con ayuda-guía colposcópica. Se han realizado varios estudios para verificar correspondencia entre diagnóstico citológico, colposcópico e histopatológico. En un estudio realizado en el Hospital Carlos Andrade Marín en el año 2014, se encontró una correspondencia de 89,0% entre diagnóstico colposcópico e histopatológico en muestras de cono LEEP por lesiones intraepiteliales de alto grado34.
Hay dos enfoques frente las lesiones intraepiteliales de alto grado: observación y tratamiento, éste último puede realizarse mediante ablación, escisión y, en casos específicos, histerectomía.
La observación mediante citología, detección de PVH y colposcopía, se puede hacer en las NIC 1 o lesiones intraepiteliales de bajo grado, por su alta tasa de remisión. En NIC 2/3 se prefiere tratar, salvo casos específicos de NIC 2 en pacientes que planean embarazo en el corto plazo.
La tendencia actual es realizar manejo de las LIE de acuerdo con el riesgo de cáncer. Katki et al elaboraron un cuadro de manejo de resultado de tamizaje con citología y PVH de acuerdo con el riesgo acumulado y la edad, los datos se resumen en las tablas 1 y 212.
La evolución de las lesiones intraepiteliales ha sido documentada en varios estudios. La mejor evidencia se obtiene del estudio de un realizado en Nueva Zelanda y que tuvo conflictos bioéticos importantes pues se estudió cohortes con y sin tratamiento, los datos se investigaron de manera retrospectiva. En la cohorte tratada la incidencia del cáncer a 10 y 30 años fue de 0,3 y 0,7% mientras que en la cohorte sin tratamiento fue de 31,0 y 50,0%35.
La observación puede realizarse en mujeres jóvenes y embarazadas. En las embarazadas la conducta puede ser observación mediante colposcopia mínimo cada tres meses o 6 semanas después del parto36.
En las mujeres jóvenes la regresión espontánea de las lesiones es alta y, si hay deseo de embarazo posterior, puede optarse por la observación37.
Si la colposcopía fue adecuada, se puede realizar ablación o escisión del cuello uterino. En colposcopía inadecuada, o NIC 2/3 recurrente, debe realizarse escisión38. El manejo de casos confirmados con biopsia se resume en el algoritmo. Figura 3.

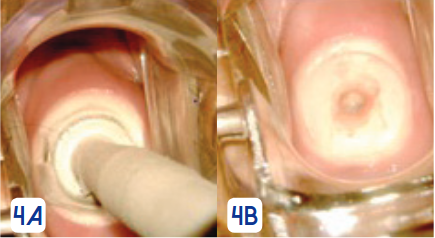
La crioterapia es el método más utilizado de ablación para lesiones de bajo grado, el procedimiento. Figura 4.
La conización se la realiza con alta frecuencia y uso de asa de tungsteno, previa infiltración de lidocaína con epinefrina. Figura 5.
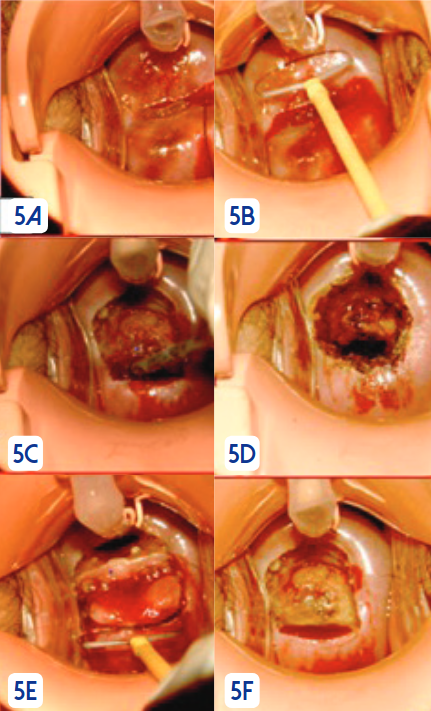
El tratamiento ha demostrado alta eficacia frente a las lesiones intraepiteliales de alto grado. Un meta-análisis en que se incluyeron 20 estudios y 5709 pacientes concluyó que el cono LEEP es tan efectivo como el cono frío en recurrencia, márgenes positivos y hemorragia; en cambio, fue más frecuente la estenosis cervical y el parto prematuro en cono frío39. Un estudio prospectivo realizado en el Hospital de Especialidades Carlos Andrade Marín de Quito con 220 pacientes sometidas a tratamiento con conización con radiofrecuencia (LEEP) para LIEAG reportó una tasa de complicaciones del 2,0%, sangrado en 1,5% y estenosis cervical en 0,5%, el seguimiento se lo realizó a 12 meses y la recidiva fue de 5,9%; la relación entre citología-colposcopía y, colposcopía-histopatológico fue significativa (p 0,000)40
.La recurrencia en pacientes con bordes libres de lesión se ha demostrado es menor que cuando los bordes están comprometidos y puede ocurrir varios años después41. Pacientes con infección por VIH también presentan mayor recidiva según varios estudios42-44
.En esta parte cabe mencionar la conducta
de ver y tratar que la OMS propone, especialmente en áreas rurales y con población
de bajos recursos. Un meta-análisis de 13
estudios y 4611 mujeres concluye que la
conducta de ver y tratar se justifica en casos
con resultados de citología para LIEAG y
colposcopía grado 2 en que se encontró un
11,6% de sobre-tratamiento; en casos de citología con LIEBG y colposcopía grado 1 el sobre-tratamiento llegó a 72,9%45.
El cáncer de cuello uterino pasa por lesiones precancerosas curables, la evolución hasta cáncer dura entre 10 y 20 años. Las recomendaciones del tamizaje han cambiado en base a la evidencia científica. El diagnóstico de las LIE es cito-colpo-histológico. Para el seguimiento de las LIE aconseja tomar en cuenta el riesgo acumulado. El tratamiento depende de la edad de la paciente, en mujeres menores de 30 años puede realizarse seguimiento y en mayores de esa edad se indica conización LEEP.
AGC: atipia de células glandulares; AGUS: atipia glandular de importancia incierta; ASC-US: atipia de células escamosas de importancia incierta; ASC-H: atipia de células escamosas con alta probabilidad de ser una lesión de alto grado; FIGO: Federación Internacional de Ginecología y Obstetricia; IVAA: inspección visual directa con ácido acético; IVI: inspección visual directa con yodo; LEEP: procedimiento de escisión electroquirúrgica con asa; LIE: lesión intraepitelial; LIEAG: lesión intraepitelial de alto grado; LIEBG: lesión intraepitelial de bajo grado; NIC: neoplasia intraepitelial; PVH: papiloma virus humano. OMS: Organización Mundial de la Salud.
DC: Recolección de información, bases de datos, elaboración de tablas, imágenes e informe final para publicación. El autor aprobó la versión final del artículo.
Diego Fernando Calderón Masón. Doctor en Medicina y Cirugía, Universidad Central del Ecuador. Magíster en Gestión de Desarrollo Social, Magíster en Gerencia de Salud, Especialista en Planificación estratégica en salud, Especialista en Ginecología y Obstetricia, Diplomado superior en Gestión de Talento Humano, Universidad Técnica Particular de Loja (UTPL). Diplomado en Bioética, Universidad Libre Internacional de las Américas (ULIA). Diplomado en Bioestadística por la Sociedad Hispana de Investigadores Cientí- ficos. PhD(c) en Medicina, Universidad Cayetano Heredia de Perú. Docente de pregrado en la Pontificia Universidad Católica del Ecuador. Médico Ginecólogo Obstetra, Hospital de Especialidades Carlos Andrade Marín. Quito-Ecuador. ORCID ID: https://orcid.org/0000-0002-7333-033X
Bases de datos libres y por suscripción.
El artículo científico fue aprobado por pares y por el Comité de Ética de Investigación en Seres Humanos – CEISH/ HECAM.
La publicación fue aprobada por el Consejo Editorial del HECAM.
Recursos propios del autor.
Los autores reportaron no tener ningún conflicto de intereses personal, financiero, intelectual, económico y de interés corporativo.
Universidad Cayetano Heredia del Perú por el acceso a las bases de datos.