 Diagnóstico y Manejo de Hipertensión Pulmonar Persistente en el Periodo Neonatal
en la Unidad de Neonatología.
Diagnóstico y Manejo de Hipertensión Pulmonar Persistente en el Periodo Neonatal
en la Unidad de Neonatología.
_____________________________________________________________________________________________________________
PROTOCOLO MÉDICO
Diagnóstico y Manejo de Hipertensión Pulmonar Persistente en el Periodo
Neonatal en la Unidad de Neonatología.
Diagnosis
and Management of Pulmonary hypertension Persistent in Period
Neonatal
in the Unit of Neonatology.
María Victoria Narváez Barros1, Luis Enrique Chancusig Paladines2

1. INTRODUCCIÓN
__________________________________________________________________________________________________________
La Hipertensión Pulmonar Persistente del Recién Nacido (HPPRN) es una emergencia médica en la etapa neonatal con una alta morbi lidad y mortalidad en los neonatos.
Este se caracteriza por una elevación sostenida de la Resistencia Vascular Pulmonar (RVP). Previamente referido como una circulación fetal persistente que es habitualmente el resultado de una tran sición pulmonar incompleta al nacer. La causa puede ser idiopá tica, consecuencia del manejo en terapia prenatal con medica mentos, neumonía, sepsis, ó a una hernia diafragmática congénita con hipoplasia pulmonar. Descrita por primera vez por Gerson y colaboradores en 1969, esta patología ocurre en 2 a 6 de cada 1 000 recién nacidos vivos y se estima que del 7 al 20% de los neonatos que sobreviven a la HPPRN desarrollan alteraciones a mediano o largo plazo tales como enfermedad pulmonar crónica, déficit au ditivo, hemorragia intracraneal y secuelas neurológicas1. La mor- talidad informada en la literatura varía entre un 10 a 20% y entre 10 y 50% en países en vías de desarrollo. La tasa de mortalidad ha disminuido mucho en la última década, pero aún queda mucho por hacer para mejorar el cuidado neonatal de esta afección en muchas áreas de países en la región latinoamericana2.
Palabras clave: Hipertensión Pulmonar; Neonatología;
Síndrome de Circulación Fetal Persistente; Recién Nacido; Enfermedades del Recién Nacido; Cuidado Intensivo Neonatal.
ABSTRACT
___________________________________________________________________________________________________________
Persistent pulmonary hypertension of the newborn
is a medical emergency
in the neonatal stage with high morbidity and mortality in neonates.
It is characterized by a sustained elevation of
pulmonary vascular resistance. Previously referred to as a persistent fetal circu lation it is usually the result of incomplete pulmonary
transition at birth.
The cause may be idiopathic, a consequence of prenatal drug therapy management, pneumonia, sepsis, or a congenital dia phragmatic hernia with pulmonary hypoplasia. First described by Gerson et al. in 1969, this pathology occurs in 2 to 6 of every 1,000 live
newborns and it is estimated that 7 to 20% of neonates who survive
persistent pulmonary hypertension of the newborn develop medium or long-term alterations such as chronic pulmonary
disease, hearing impairment, intracranial hemorrhage and neurolo gical sequelae1. Mortality reported in the literature varies between 10 to 20% and between 10 and 50% in developing countries. The mortality rate has decreased greatly in the last decade, but much remains
to be done to improve
neonatal care of this condition
in many areas of countries
in the Latin American region2.
Keywords: Hypertension, Pulmonary; Neonatology; Persistent Fetal Circulation Syndrome; Infant, Newborn; Infant, Newborn, Diseases; Intensive Care, Neonatal.
2. OBJETIVOS
__________________________________________________________________________________________________________
2.1 Objetivo General
Normatizar los criterios diagnósticos y manejo terapéutico de HPPRN a término y prematuros en la Unidad de Neonatología del Hospital de Especialidades Carlos Andrade Marín (HECAM).
2.2 Objetivos específicos
- Definir y establecer los criterios diagnósticos de la HPPRN
en la Unidad de Neonatología del HECAM.
- Normatizar las estrategias terapéuticas de manera sistemá
tica y optimizar el cuidado
del recién nacido
tanto del Per sonal de Enfermería como del Personal
Médico.
- Sistematizar el manejo terapéutico
para hipertensión pulmonar persistente del recién nacido
en Unidad de Neonato logía
del HECAM.
3. ALCANCE
_________________________________________________________________________________________________________
Este protocolo es de tipo clínico para diagnóstico y tratamiento de la hipertensión pulmonar en el período neonatal.
Está creado por la Unidad
Técnica de Neonatología y dirigido a la jefatura,
médicos tratantes, médicos residentes asistenciales, médicos posgradistas, jefatura de enfermería y
enfermeras, con la fina lidad de normatizar los criterios diagnósticos y manejo terapéutico de la HPPRN a término
y prematuros en la Unidad
de Neo natología del HECAM
4. MARCO TEÓRICO
____________________________________________________________________________________________________________
Definiciones:
- Hipertensión pulmonar: es una
patología de la circulación pulmonar
producida por alteraciones intrínsecas del endo telio vascular pulmonar, o la presencia de enfermedades car-diacas, pulmonares subyacentes o sistémicas.
- HPPRN: es una afectación en la cual la Resistencia Vascular Pulmonar (RVP) se mantiene
anormalmente elevada luego del nacimiento, resultando en un hipoflujo pulmonar
con o sin shunt (cortocircuito) de derecha a izquierda a través del conducto arterioso
o del foramen oval3.
Fisiología:
Circulación fetal y postnatal
En el feto, los circuitos pulmonar y sistémico operan en
para- lelo. Los pulmones
fetales se encuentran colapsados y ocupados por líquido amniótico, estos no son funcionales y se encuentran básicamente en etapa de desarrollo, la misma que la realiza en un medio hipóxico; en la vida fetal la hematosis se realiza en la placenta, la vena umbilical se encarga de llevar sangre con alta concentración de O2, que posteriormente se une con la vena in- trahepática para continuar con la vena cava inferior, en donde se mezcla con sangre venosa llevando
así sangre mezclada
a la au rícula derecha,
en donde la mayor parte de sangre
pasa a través del foramen
oval hacia la aurícula izquierda, mientras que el 7% de
la sangre que llega a la aurícula derecha pasa al ventrículo derecho
desde donde se inyecta hacia
los pulmones a través de la arteria
pulmonar; de este volumen, el 90%, pasa a través
del ductus hacia la aorta la misma que se mezcla con la sangre
pro- cedente del ventrículo izquierdo y retorna a la placenta
a través de las arterias
umbilicales3 (Figura 1). Por lo tanto, el flujo pu monar es escaso y la pequeña cantidad
que reciben los pulmones es básicamente para mantener la perfusión de los alveolos
mas no para la homeostasis;
por tal razón, la RVP es muy alta y supera a la sistémica en el feto.
Figura 1. Circulación fetal
Fuente. Ann R Stark, MD Eric C Eichenwald, MD Hipertensión pulmonar persistente del recién nacido.
2018 UpToDate
En la circulación postnatal, el retorno
venoso pasa a través del corazón derecho
a las arterias pulmonares, la RVP cae y
permite que exista un flujo pulmonar y se produzca el intercambio de gases. La
sangre oxigenada regresa al lado izquierdo del corazón y se bombea a la
circulación sistémica para
administrar oxígeno a los tejidos. No se produce mezcla entre los dos lados de la circulación.
Circulación transicional
Los principales ajustes
circulatorios ocurren al nacer ya que, el pulmón del recién nacido (RN) inicia
su función principal que es el intercambio de gases, esto se consigue
gracias a la disminución progresiva de la RVP,
acompañada del au- mento inmediato de
la resistencia vascular sistémica (RVS) y de
esta manera iniciando la circulación normal. Los factores que contribuyen al aumento postnatal de la
RVS son la eliminación de la placenta, la oleada de catecolaminas asociada con el nacimiento y el entorno
extrauterino relativamente frío. Los factores
que promueven la disminución posnatal
de RVP son la expansión del pulmón con aire, el líquido de los
alveolos se absorbe rápidamente y se establece el inter- cambio gaseoso.
Patogenia:
La HPPRN no debe ser considerada como una entidad nosoló gica,
ya que, son muchas las enfermedades de etiología diversa
que por diferentes mecanismos producen la elevación de la RVP y la consecuente hipertensión pulmonar. La identificación de la
causa es importante para el tratamiento etiológico y para estimar el pronóstico4.
●
Subdesarrollo:
Existe una
disminución del área de corte transversal
del lecho vascular pulmonar o hipo desarrollo con un incremento de la reactividad de los vasos
pulmonares a la hi poxia.
Esta anomalía ocurre
en:
-
Hipoplasia pulmonar
-
Hernia Diafragmática Congénita (HDC)
-
Malformación Pulmonar
Congénita (Enfermedad Adenomatoidea Quística)
- Agenesia renal
-
Oligohidramnios que acompañan Uropatía
Obstructiva y Restricción del Crecimiento Fetal.
● Mal desarrollo: Ocurre en los pulmones
bien desarrollados, pero
con un lecho vascular anormal
caracterizado por engrosa-
miento anormal de la capa muscular de las arteriolas. Las afecciones
asociadas con la HPPRN causadas por mal desarrollo vascular incluyen6:
-
RN postérmino.
-
Cierre prematuro del ductus arterioso causado por fármacos antiinflamatorios no esteroideos (AINE) o foramen oval.
-
Resistencia vascular placentaria alta como ocurre en la pree clampsia.
-
Hipoxia intrauterina crónica.
-
Encefalopatía hipóxico-isquémica
-
Drenaje Venoso Pulmonar Anómalo Total.
● Mala adaptación: En la mala adaptación, el
lecho vascular pulmonar
se desarrolla normalmente y la hipertensión pulmonar se produce secundaria a vasoespasmo de la
arteria pulmonar como consecuencia de
hipoxia severa aguda, hipercapnia y/o acidosis por enfermedad parenquimatosa pulmonar. En la Mala adaptación ocurre5:
-
Síndrome de Aspiración de Meconio (SAM)
-
Síndrome de Dificultad Respiratoria
-
Neumonía / Sepsis
-
Otros estados patológicos como son hipercarbia, hipotermia etc.
Factores de Riesgo:
Se consideran como factores de riesgo para HPPRN ciertos
es tados patológicos
maternos, así como factores ligados al naci
miento. Tabla 1.
Tabla 1. Factores de Riesgo para HPPRN.

Prenatales Postnatales

Preeclampsia Nacimiento por cesárea
Diabetes materna RN pretérmino tardío (34 a 36 semanas
6 días)
Sobrepeso y obesidad RN postérmino (Mayor a 42 semanas)
Uso de AINEs (ibuprofeno,
ácido
acetilsalicílico, diclofenaco, metamizol)
Consumo de drogas y tabaquismo

Fuente. Golombek
S, Sola A, Lemus L, SIBEN M del C de. Recomendaciones del VI Consenso Clínico de SIBEN para la Hipertensión Pulmonar Persistente del Recién Nacido. 1 de mayo de 2017; 18(5):e327-
443.
Modificada por: Autores.
5. INVOLUCRADOS
___________________________________________________________________________________________________________
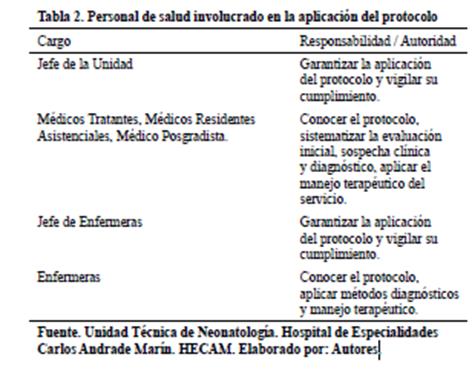
6. ACTIVIDADES
___________________________________________________________________________________________________________
Diagnóstico:
•
Hallazgos Clínicos
Se sospecha
clínicamente de HPPRN cuando se presenta los siguientes signos:
- RN con signos de dificultad
respiratoria después del nacimiento que se acompaña de cianosis e hipoxemia
desproporcionadas al grado de patología
pulmonar6.
- Presencia de labilidad en la oximetría
de pulso (cambios súbitos y desproporcionados
de la saturación de oxígeno (SpO2))
frente a estímulos como el llanto, cambios de posición, colocación de accesos venosos, sondas orogástricas, cambio
de pañal y otros procedimientos.
- Al examen físico puede encontrarse
ruidos cardíacos anó malos, con la presencia de soplo sistólico de regurgitación tricuspídea4.
Frente
a la sospecha clínica se recomienda realizar
la prueba de gradiente pre y postductal, que se
describe a continuación.
• Determinación del Gradiente Preductal
Es útil para confirmar la presencia de shunt o
cortocircuito de derecha a izquierda a nivel ductal
que existe en el 50 a 60% de los RN con HPPRN3. Figura
2.
Figura 2. Caracterización de la función
ventricular y dirección
del cortocircuito para
realizar diagnóstico diferencial y conocer las dianas farmacológicas.
CA: Conducto
arterioso, FO: Foramen oval, PGE1: Prostaglandina E 1, HPPN: hipertensión pulmonar persistente neonatal, iON: Óxido
Nítrico inhalado, HD: Hernia
diafragmática, SAM: Síndrome de aspiración de
meconio, AgP: Agenesia pulmonar, AT:
atresia tricuspídea, DS: Déficit de
surfactante, RLPF: Retención de líquido pulmonar fetal, DVPAT: drenaje
venoso pulmonar anómalo
total, AD: Aurícula derecha,
AI: aurícula izquierda, VD: ventrículo derecho, VI: Ventrículo izquierdo. Imagen histopatológica con hiperplasia concéntrica de las capas de la arteria cortesía del Dr. Guillermo Ramón García.
Departamento de Patología HIMFG. Ecocardiograma cortesía
Dr. Julio Erdmenger
Orellana. Cardiología HIMFG. Modificado de: Lakshminrusimha S. Semin Perinatol. 2014 Mar;38(2):78-91.
Fuente: Villanueva D. Programa de Actualización Continua. PAC. Fed Nac Neonatol México AC. 2016; 4:82. ISBN:978-607-443-552-821
Esta prueba consiste en medir el grado de oxigenación pre y postductal, se puede medir por determinación de la SpO2 en oxi- metría de pulso o presión arterial de oxígeno (PaO2) en gasome tría7.
• Saturación de oxígeno (SpO2)
Se realiza utilizando un oxímetro de pulso. Para la medición
de la oxigenación pre ductal,
se deberá colocar
el sensor de oxime- tría únicamente en la mano o muñeca derecha
y para determina ción de la oxigenación postductal, se deberá colocar el sensor en la mano o muñeca izquierda; además, se puede utilizar las extre midades inferiores. Este método es de
fácil aplicación y no re- quiere de procedimientos invasivos como es la punción arterial8.
• Presión arterial de oxígeno
(PaO2)
Este método se realiza a través de la medición
de gases sanguíneos arteriales, específicamente la PaO2, para lo cual se debe realizar una punción arterial en los mismos
territorios pre y post ductales utilizados en oximetría
de pulso. Habitualmente no es un método de uso frecuente
en neonatología por lo cruento
que resulta este procedimiento.
La existencia de una oxigenación preductal mayor que la post-
ductal se produce
cuando existe una relación anormal
entre las grandes
arterias, y la sangre desoxigenada procedente de la ar teria pulmonar, pasa a la aorta
descendente a través del ductus arterioso. En la Tabla 3 se muestra la diferencia en la oxigena
ción pre o postductal que se observa
al aplicar ambos métodos.

Una prueba negativa
no excluye el diagnóstico, pues cuando hay un cortocircuito significativo de
derecha a izquierda a nivel de foramen oval o cuando hay hipoflujo pulmonar sin
shunt, no se produce esta diferencia pre – post ductal. Si el gradiente pre y
postductal en normal y se mantiene la sospecha clínica se recomienda la
valoración ecocardiografía ya que este en el método diagnóstico confirmatorio3.
• Índice de
Oxigenación (IO)
En HPPRN no es lo más
adecuado; su mayor debilidad es que el valor de la presión media de la vía
aérea no sólo depende de la
gravedad de la
patología pulmonar sino también de la habilidad del médico neonatólogo tratante
para ventilar a los RN3.
• Ecocardiograma
Es el método estándar
de oro en HPPRN, la técnica doppler es un excelente complemento no invasivo
para estimar la presión de la arteria pulmonar que se detecta en más del 90%.
La Organización Mundial de la Salud ha definido HPPRN como una presión
sistólica de la arteria pulmonar >30 mmHg3. Las ventajas
del Ecocardiograma
son:
- Determina la
severidad de la HPPRN.
- Descarta
alteraciones estructurales (transposición de grandes vasos, retorno venoso
anómalo o atresia pulmonar u otras).
- Permite además la
caracterización de la función ventricular y dirección del cortocircuito para
poder diferenciar la etiología y discernir entre fármacos que pueden mejorar o
empeorar la situación hemodinámica9.
• Radiología
Su uso puede ser complementario pues la mayoría de los estudios son normales,
pero llama la atención la desproporción entre las necesidades de oxígeno y las escasas
alteraciones radiológicas.
Al ser secundaria a una neumonía o hernia diafragmática, se ob servarán
las lesiones específicas respectivas de consolidación pulmonar o la presencia de asas intestinales en el tórax.
Tratamiento:
Una vez establecido el diagnóstico de HPPRN se aplican las me didas terapéuticas, inclusive algunas de ellas se pueden aplicar
frente a la sospecha clínica.
• Medidas Generales y de Sostén
- Manejo mínimo: evitar estímulos innecesarios como agitación, llanto, punciones venosas, aspiración de secreciones.
- Mantener ambiente
térmico neutro: evitar hipertermia e hipotermia mantener temperatura entre 36-36,5 (axilar)
o 36,5- 37,5 (rectal),
la hipertermia aumenta consumo de O2 y aumenta la acidemia.
- Balance hidroelectrolítico y
prevenir o corregir alteraciones metabólicas:
• Balances hídricos negativos y
valorar el aporte hídrico diario según
el peso, balance hídrico, tensión arterial, diu resis y densidad
urinaria. Tabla 4.
•
Glucemia entre 60-90 mg/dl.
• Mantener calcemia y magnesemia en los valores
normales (calcio sérico: 1.1
– 1.4 mmol/L o 4,4 – 5,6 mg/dl); magnesio: 1,26-2,1 mEq/l)10.
• Evitar uso de diuréticos (Morbilidad asociada: hipotensión, hipokalemia, hiponatremia, hipocloremia, alcalosis metabó lica,
hipoacusia, trastornos a largo plazo).
•
Evitar pH anormal mantener
> 7,15 - < 7,50
• Uso de sedantes y parálisis muscular
Indicado en casos muy severos, con gran labilidad de la oxigenación y ‘lucha’ con el ventilador, se
recomienda el uso de sulfato
de morfina o fentanilo además se puede incluir
bloqueadores neuromusculares como rocuronio3.
• Surfactante
En algunos neonatos prematuros tardíos o de término las enfermedades parenquimatosas pulmonares están frecuentemente asociadas a deficiencia de surfactante,
inactivación del mismo o ambos. Los
estudios reportan reducción de la necesidad de
oxigenación por membrana extracorpórea (del inglés ECMO) y más efectividad cuando se administra
tempranamente en el curso de la enfermedad3.
• Oxigenación y Soporte Ventilatorio
1.
Durante el manejo inicial
se recomienda tener un monitor
de SpO2 en posición pre ductal y otro postductal para deter minar si hay un shunt ductal de derecha a izquierda.
2.
La
administración de la fracción inspirada de oxígeno (FiO2) debe ser la necesaria para mantener SpO2 preductal entre
91% como mínimo y 96% como máximo
(programar
alarmas en 90% y 97%). La administración de oxígeno se puede realizar a través de cánula nasal, Presión positiva con tinua
en las vías respiratorias (CPAP)
o Ventilación Mecá
nica Invasiva (VMI)10.
3. En
el caso de VMI se recomienda mantener
presión posi tiva
al final de la espiración (PEEP) entre 6- 8mmhg, evitar
presiones o volúmenes
exagerados en inspiración o tiempo inspiratorio prolongado; los paramentos gasométricos espe rados son pH de 7,25-7,30, PaO2 pre
ductal de 55-70mmHg
y PaCO2 de 45-50mmHg (gasometría arterial).
4. Ventilación de alta frecuencia (VAF) está indicada cuando otros tipos de ventilación no han sido efectivos; puede
me jorar los niveles
de oxígeno y de CO2 en la sangre (indicado
en presión inspiratoria máxima (PIM) >30 cmH2O)11.
5.
Oxigenación
por membrana transcorpórea (ECMO) se usa
como terapia de rescate cuando la VAF y el NO o sildenafil fracasan
en el tratamiento de los neonatos graves con HPPRN.
6. El destete del ventilador debe ser en tiempo oportuno, sin demoras, pero
lento y gradual sólo después de un periodo de relativa
estabilidad con oxemias normales durante 12-24
horas.
 Tabla 4. Líquidos y electrolitos en el Recién Nacido.
Tabla 4. Líquidos y electrolitos en el Recién Nacido.
Aporte basal: Según peso y edad postnatal
|
Días de vida
|
menor a 750g
|
750-1 000g
|
1 000-1 500g
|
Mayor a 1 500g
|
|
1-2
|
100ml/kg/día
|
80ml/kg/día
|
70-80ml/kg/día
|
70-80ml/kg/día
|
|
3-7
|
150- 200ml/kg/día
|
100-150ml/kg/día
|
80-150ml/kg/día
|
100-150ml/kg/día
|
|
7-28
|
120-180ml/kg/día
|
120-180ml/kg/día
|
120-180ml/kg/día
|
120-180ml/kg/día
|
Fuente: Tomado del Protocolo
de Manejo de Líquidos y electrolitos en el Recién
Nacido Prematuro en la Unidad
de Cuidados Intensivos Neonatales. HCAM 2018
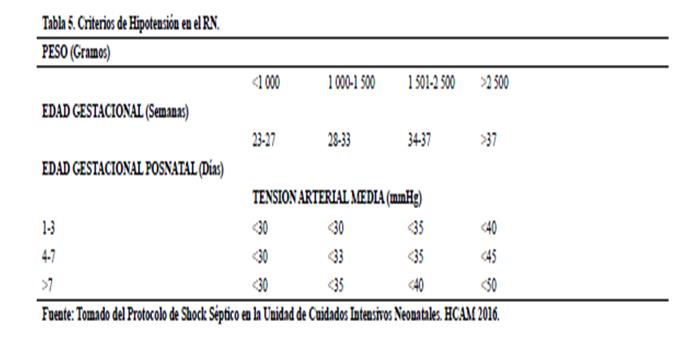
• Perfusión Óptima
Mantener un valor de Hematocrito adecuado
evitando hipervis cosidad
(Hematocrito >45% menor 65%)
Se recomienda mantener
la tensión arterial
(TA) sistólica en el RN a
término entre 70-80 mmHg y TA media de 40-55 mmHg. En el caso de prematuros. Tabla
5.
El uso de agentes inotrópicos está indicado cuando hay
signos de disminución del gasto
cardíaco, o cuando existe una perfusión renal disminuida. Los inotrópicos recomendados son dopa- mina, dobutamina, en algunos casos se puede usar a adrenalina y norepinefrina ya que incrementan la presión sistémica y pueden mejorar el gasto cardíaco en neonatos con HPPRN, sin embargo su uso debe ser bien analizado ya que también pueden tener efecto sobre
la presión pulmonar3.
• Tratamiento Farmacológico
El objetivo fundamental del tratamiento consiste en dilatar la vas culatura pulmonar y disminuir la relación entre la Presión Arterial Pulmonar y la Presión Arterial Sistémica3.
- Óxido Nítrico (NO)
Es uno de los más importantes reguladores de la presión
y flujo sanguíneo vascular. El NO es un gas administrado por inhalación para difundirse rápidamente a las células del músculo liso vascular pulmonar y producir vaso-relajación. Para su uso se debe tomar en cuenta algunas recomendaciones que se exponen en la Tabla 612.
El NO se administra por medio de un equipo dosificador especial, que a través de un inyector de flujo introduce el gas en rama inspi ratoria del ventilador en la concentración deseada. Las dosis y ad- ministración se exponen en la Figura 3.
Figura 3. Algoritmo de
Manejo con NO en
pacientes con HPPRN en el periodo
neonatal en la Unidad Técnica
de Neonatología
Hospital Carlos Andrade Marín.
Fuente: Golombek S, Sola A, Lemus L, SIBEN M del C de. Recomendaciones del VI Consenso Clínico de SIBEN para la Hipertensión Pulmonar Persistente del Recién Nacido. 1 de mayo de 2017;18(5):e327-443. Modificado por: Autores.
Figura 4. Algoritmo de Manejo de Pacientes con HPPRN en el Periodo Neonatal en la Unidad Técnica de Neonatología Hospital Carlos Andrade Marín.
Fuente: Unidad Técnica de Neonatología. Hospital de Especialidades Carlos Andrade Marín. HECAM. Elaborado por: Autores.
Tabla 6. Recomendaciones para el uso de Óxido Nítrico en el Recién Nacido (modificado de la American Academy of Pediatrics).

1.- RN con falla respiratoria hipóxica:
deben tratarse en centros con experiencia en proveer tratamiento ventilatorio complejo (incluida VAF) y terapias de rescate o ser trasladados a tiempo.
2.- Debe administrarse de acuerdo a las indicaciones, dosis, modo de administración y monitoreo.
3.- Se debe realizar un ecocardiograma para descartar cardiopatía congénita y evaluar HPPRN.
4.- El tratamiento con NO, debe ser dirigido por médicos calificados y experimentados en su uso.
5.- Si el RN requiere traslado, este debe realizarse sin interrumpir NO.

Fuente: Golombek
S, Sola A, Lemus L, SIBEN M del C de. Recomendaciones del VI Consenso Clínico de SIBEN para la Hipertensión Pulmonar Persistente del Recién Nacido. 1 de mayo de 2017;18(5):e327-443. Modificado por: Autores.
- Sildenafil - Inhibidor Selectivo de la Fosfodiesterasa5
Las fosfodiesterasas es una enzima importante que regula la rela jación vascular pulmonar, es de administración oral y es conside rado como un medicamento promisorio para el tratamiento de la HPPRN, especialmente en aquellos sitios donde no se encuentra disponible el NO4,13.
Dosis – administración
Dosis: se indica 0,5 a 2 mg por kg dosis cada 6- 8 horas
-
Milrinona
Es un inhibidor
de la fosfodiesterasa III , que provoca
la libera ción de calcio en el miocito cardíaco y
de la musculatura lisa, consiguiendo
aumento de la contractibilidad miocárdica y va- sodilatación por relajación de la musculatura lisa vascular con disminución de las resistencias vasculares pulmonares. La milri nona
es un fármaco utilizado como terapia de emergencia sobre todo cuando
existe falla en el uso de NO, en otros casos ha mostrado
efectividad en cuadros
de HPPRN con disfunción ventri
cular izquierda3.
7. RUTA DEL PACIENTE
_________________________________________________________________________________________________________
Tabla 5. Ruta de pacientes con HPPRN en el Período Neonatal

Paciente El paciente será atendido en:
1. Urgencias pediátricas o interconsulta dentro otra unidad
del HCAM.
2.
Unidad de Neonatología.
Evaluación Inicial Valoración por médico tratante, el cual realizará:
1.
Historia clínica. Determinar factores de riesgo.
2.
Examen físico
3. Ante sospecha clínica:
a.
Realizar gasometría arterial y/o venosa.
b. Determinar el gradiente pre y
postductal.
c. Monitoreo de SpO2.
d. PaO2 si es posible.
e. Valorar si amerita IO.
4.
Solicitar estudios complementarios
a.
Ecocardiograma.
b.
Radiografía de tórax.
5.
Medidas generales y de sostén.
6.
Terapéutica individualizada.
Evaluación
Subsecuente
Valoración por médico tratante y/o posgradista, el
cual realizará:
1. Historia clínica. Determinar
factores de riesgo.
2. Examen físico.
3. Revisión de estudios
complementarios, establecer
diagnóstico y toma de decisiones
de acuerdo a
algoritmo de manejo.
a. Alta.
b. Solicitud de estudios
adicionales (Laboratorio,
imagen, etc.)
4. Medidas generales y de sostén.
5. Terapéutica individualizada.
a. Manejo clínico.
b. Valorar procedimientos
invasivos y/o quirúrgicos.
6. Valoración de interconsultas a
otras unidades y/o
requerimiento de derivación para
manejo integral
Evaluación
subsecuente post
operatoria y/o
manejo
clínico
Valoración por médico tratante y/ocual realizará:
1. Historia clínica y examen físico.
Valorar la
evolución clínica.
2. Revisión de estudios complementarios,
establecer
diagnóstico y toma de
decisiones de acuerdo al
algoritmo de manejo.
a. Alta.
b. Solicitud de estudios
adicionales (Laboratorio,
Imagen, etc.)
3. Terapéutica
individualizada
a. Manejo clínico.
b. Valorar procedimientos
invasivos y/o quirúrgicos
4. Valoración de
interconsultas a otras unidades y/o
requerimiento de
derivación para manejo integral.
5. Decisión de alta hospitalaria y control ambulatorio
Evaluación
subsecuente Control
en Consulta Externa
1. Toma de signos vitales en el área de enfermería.
2.Ingresa a la consulta
con el médico tratante, el cual realizará:
3.Historia clínica.
4.Examen físico.
5. Revisión de exámenes de laboratorio y revisión de complementarios.
6. Terapéutica
individualizada.
7.
Se evaluará
complejidad teniendo en cuenta las comorbilidades
del paciente,
para su seguimiento, alta definitiva o derivación a segundo nivel de atención.

Fuente: Unidad Técnica de Neonatología. Hospital de Especialidades Carlos Andrade Marín. HECAM. Elaborado por: Autores.
8. COMPLICACIONES Y/O DESVIACIONES DEL PRO TOCOLO
___________________________________________________________________________________________________________________________
Hipertensión
Pulmonar (HP) asociada a Displasia Bronco-
pulmonar (DBP)
Para los RN a término > 3 meses, la definición de HP es
la misma que en adultos:
presión arterial pulmonar
(PAP) media
≥25 mmHg a nivel del mar14. No existe una definición específica para bebés prematuros.
Historia Natural, Patogenia y Factores de Riesgo
Entre el 20 y el 40 por ciento de los neonatos con DBP desarro llan HP y generalmente se desarrolla durante los primeros meses de vida. En una serie
de RNs con peso extremadamente bajo al nacimiento (peso al nacer <1 000 g) el
7% desarrolló HP a las cuatro semanas de vida, y el 20% desarrolló HP al alta hospita laria. Los neonatos que sobreviven a las etapas iniciales de la HP a menudo experimentan mejoría o
resolución debido al crecimiento y desarrollo pulmonar de recuperación14.
En los neonatos con DBP, los mecanismos que contribuyen al desarrollo de la HP incluyen:
- Lecho vascular pulmonar anormal: la HP en lactantes con DBP se caracteriza por una
reducción absoluta en el tamaño lecho vascular pulmonar,
con aumento del tono del músculo liso de la arteria
pulmonar y aumento de la reactividad de las arterias a una variedad de estímulos15.
- Toxicidad por oxígeno y barotrauma: los efectos de la toxi cidad por oxígeno y el barotrauma o volutrauma inducidos
por el ventilador en el pulmón inmaduro también pueden interferir
en el desarrollo alveolar, con un número reducido de alvéolos
y de las arterias intraacinares. Las consecuencias de estos eventos pueden incluir un
deterioro en la producción de NO y un factor de crecimiento endotelial vascular16.
- Hipoxia alveolar: paradójicamente, la hipoxia y acidosis alveolar crónica o intermitente causan vasoconstricción aguda y producen un cambio estructural
adicional en las arterias pulmonares afectadas, incluida la lesión
de células endote
liales, la proliferación de la íntima, la hipertrofia medial y la extensión del músculo hacia la pared arterial.
- Estenosis de la vena pulmonar (EVP):
los neonatos prematuros pueden desarrollar HP secundaria a la estenosis
de la vena pulmonar, que en general
se desarrolla después
en los primeros meses de vida. La EVP puede coexistir con la DBP o puede desarrollarse en bebés
prematuros que tienen una enfermedad pulmonar mínima.
La EVP no responde bien a la farmacoterapia típica dirigida al HP
y se asocia con una alta mortalidad17.
Los factores predictivos de riesgo de desarrollar HP incluyen:
-
DBP severa.
-
La prematuridad extrema.
-
Muy bajo peso al nacer (<1
500 g).
-
Ventilación mecánica prolongada.
-
Terapia de oxígeno prolongado.
-
Anomalías anatómicas cardiovasculares, como estenosis de
la vena pulmonar, ductus
arterioso permeable y colaterales aorta-pulmonares
-
Oligohidramnios.
-
Retardo del crecimiento intrauterino.
Los factores que contribuyen al desarrollo de la DBP
también pueden contribuir al desarrollo
o la gravedad de la HP en neo- natos prematuros, estos factores incluyen:
-
Ventilación con presión positiva.
-
Uso de altas concentraciones de oxígeno suplementario.
-
Aspiración crónica debido a disfunción de la deglución y / o reflujo gastroesofágico.
-
Nutrición subóptima18.
Diagnóstico y Evaluación Temprana
La identificación temprana de la HP es útil para optimizar la terapia y minimizar
los riesgos. Sin embargo, el momento óptimo
para la detección es incierto
por lo que se sugiere
como prueba de detección universal la ecocardiografía la misma que debe rea lizarse
en los siguientes casos:
Realizar un ecocardiograma en el momento
en que se realiza el diagnóstico formal
de Displasia Broncopulmonar.
Se recomienda realizar una ecocardiografía en una etapa más temprana en aquellos neonatos con síntomas o factores de riesgo importantes para la HP, como son:
• Necesidad de soporte de ventilador en el séptimo
día post- natal.
• Necesidad de soporte respiratorio desproporcionado a su en fermedad pulmonar.
• Episodios recurrentes o severos de hipoxemia.
•
 Hipercarbia persistente (PaCO > 60 mmHg)19.
Hipercarbia persistente (PaCO > 60 mmHg)19.
• En neonatos de alto riesgo que están
programados para un procedimiento
anestésico, ya que la HP está asociada con un mayor riesgo de complicaciones durante la anestesia, ge- neralmente durante la inducción y
emergencia de la anestesia. Se debe además considerar la realización de ecocar diograma en paciente con DBP moderada o severa antes del alta19.
Una vez identificados los neonatos con DBP y que tiene riesgo de desarrollar HP la ecocardiografía es
el método más usado ya que es inocuo
y permite además monitorear la progresión de la HP, sin embargo, la cateterización cardíaca
es el estándar de oro para
el diagnóstico de HP, así como para determinar la gravedad, pero se realiza solo en casos seleccionados.
Los criterios para cateterismo cardiaco son:
- Neonatos con HP grave que no responden
a una terapia conservadora y son
candidatos para un tratamiento farma cológico a largo plazo19.
- En
casos de deterioro clínico y evidencia
ecocardiográfica de aumento
de HP o disminución de la función
ventricular.
-
Para determinar la utilidad de la farmacoterapia dirigida
a la HP, ya que algunos neonatos pueden no responder
al tratamiento.
Los objetivos principales del manejo de la HP en neonatos
con DBP son optimizar el
tratamiento de la enfermedad pulmonar crónica
para mejorar el intercambio de gases, evitar la vaso- constricción hipoxémica, prevenir una lesión pulmonar adicional y optimizar el crecimiento pulmonar.
•Medidas Generales
En pacientes con HP asociada a la DBP leve o moderada el manejo terapéutico se basa en la
aplicación de medidas generales.
Uso de oxígeno suplementario: en concentraciones necesarias para mantener las saturaciones de
oxígeno entre 92 y 95%, para maximizar el crecimiento pulmonar
y reducir la PAP20.
Paciente con apoyo ventilatorio se debe utilizar
estrategias para minimizar el
barotrauma.
Otras medidas para maximizar el crecimiento de los pulmones,
incluida una nutrición adecuada y evitar la infección respiratoria y la
aspiración.
• Terapia Farmacológica
Para la HP asociada con DBP moderada o grave que no responde
a las medidas anteriores, se puede considerar la farmacoterapia.
- Sildenafil es el agente que se usa más
comúnmente para tratar el HP asociado
con la DBP. Los eventos adversos informados
en estudios de sildenafil en lactantes con DBP
incluyen hipotensión transitoria, episodios de desaturación de oxígeno2.
- El NO inhalado se usa a menudo para el
tratamiento de crisis agudas de HP. Se retira después de la estabilización, a menudo mediante
la transición a un medicamento a largo plazo
como el sildenafil20.
- Otros fármacos: son útiles para el tratamiento de la HP aso- ciada con la DBP incluye
bosentan, iloprost inhalado,
epo prostenol intravenoso y treprostinil18.
• Monitoreo
Si se diagnostica HP, sugerimos ecocardiogramas de seguimiento mensuales hasta que los hallazgos anormales
se norma licen o se estabilicen14. Los
ecocardiogramas de seguimiento más
frecuentes también deben considerarse en niños con DBP y antecedentes de HP que experimentan una exacerbación pulmonar
aguda y persistente, o en aquellos tratados
con farmacoterapia dirigida
a la HP.
• Limitación de Insumos,
Medicamentos y/o Estudios
Com plementarios
Unos de los problemas que puede presentarse para el adecuado
manejo clínico de los pacientes
es la limitación en cuanto
a insumos o medicamentos. Esto
se puede deber al no abasteci- miento en la farmacia
hospitalaria o a nivel nacional.
Teniendo en consideración estas potenciales condiciones, como lo es principalmente
la no disponibilidad de NO, se ha considerado el uso de otras opciones
terapéuticas como es el sildenafil.
Otra limitación es la no disponibilidad de equipo ecocardiográ fico adecuado para la evaluación gold estándar, sin embargo, contamos con algunos criterios clínicos que ya se mencionaron.
Como actividades complementarias, debería tomarse en cuenta revisar
los equipos idóneos
como monitores cardiológicos fun cionantes, ventiladores que brinden alta frecuencia, bombas
de infusión disponibles,
tener fórmulas disponibles para cálculos. Esta patología no debería ser manejada sin el apoyo de Cardio
logía Pediátrica tanto en evolución diagnóstica y tratamiento.
ABREVIATURAS
___________________________________________________________________________________________________________
AINE: Antiinflamatorios no esteroideos, CPAP: Presión positiva continua
en las vías respiratorias, DBP: Displasia Bronco-
pulmonar, ECMO: Oxigenación por membrana extracorpórea, FiO2: Fracción inspirada de oxígeno, HECAM:
Hospital de Es pecialidades Carlos Andrade Marín, HPPRN: Hipertensión pul monar
persistente del recién
nacido, IO: Índice
de oxigenación, NO: Óxido nítrico, PaO2: Presión arterial de oxígeno, PAP: Presión arterial
pulmonar, PEEP: Presión
positiva al final
de la es piración,
PIM: Presión inspiratoria máxima, RN: Recién nacido, RVP: Resistencia vascular pulmonar, RVS: Resistencia vascular sistémica, SAM: Síndrome de aspiración
de meconio, SIBEN: Sociedad
Iberoamericana de Neonatología, SpO2: Saturación de Oxígeno, VAF: Ventilación de alta frecuencia, VMI: Ventilación Mecánica
Invasiva.
CONTRIBUCIÓN DE LOS AUTORES
___________________________________________________________________________________________________________
MN, LCh: Concepción y diseño del trabajo; Recolección / ob tención, análisis e interpretación de datos; Redacción del manuscrito;
Revisión crítica del manuscrito; Aprobación de su versión final,
Rendición de cuentas.
(ICMJE).
DISPONIBILIDAD DE DATOS Y MATERIALES
___________________________________________________________________________________________________________
Se utilizaron recursos
bibliográficos de uso libre y limitado. La información recolectada está disponible bajo requisición al autor principal.
APROBACIÓN DE GERENCIA GENERAL
Y DIRECCIÓN TÉCNICA
___________________________________________________________________________________________________________
El protocolo médico fue aprobado
por pares y por las máximas autoridades.
CONSENTIMIENTO PARA PUBLICACIÓN
___________________________________________________________________________________________________________
La publicación fue aprobada por el Comité
de Política Editorial
de la Revista Médico Científica CAMbios del HECAM en Acta 002 de fecha 07 de abril de 2023.
FINANCIAMIENTO
___________________________________________________________________________________________________________
Se trabajó con recursos propios de los autores.
CONFLICTOS DE INTERÉS
___________________________________________________________________________________________________________
Los autores reportaron no tener ningún conflicto de interés, per sonal, financiero, intelectual,
económico y de interés corporativo.
REFERENCIAS BIBLIOGRÁFICAS
___________________________________________________________________________________________________________
1. Porta NFM, Steinhorn RH.
Pulmonary vasodilator the- rapy in the NICU: inhaled nitric
oxide, sildenafil, and other pulmonary vasodilating agents. Clin Perinatol. marzo de 2012;39(1):149-64.
Available from: https://pubmed.ncbi. nlm.nih.gov/22341543/
2.
Vargas-Origel
A, Gómez-Rodríguez G, Aldana-Valen- zuela C, Vela-Huerta MM, Alarcón-Santos SB, Ama- dor-Licona N. The use of sildenafil in
persistent pulmo- nary hypertension
of the newborn. Am J Perinatol. marzo de 2010;27(3):225-30. Available from: https://pubmed.ncbi. nlm.nih.gov/19866403/
3.
Golombek
S, Sola A, Lemus L, SIBEN M del C de. Re- comendaciones
del VI Consenso Clínico de SIBEN para la
Hipertensión Pulmonar Persistente del Recién Nacido. NeoReviews [Internet]. 1 de mayo de 2017;18(5):e327-
44. Disponible en: https://publications.aap.org/neore- views/article-abstract/18/5/e327/89446/Recomenda- ciones-del-VI-Consenso-Clinico-de-SIBEN?redirecte- dFrom=fulltext
4.
Gasque
Góngora JJ. Hipertensión pulmonar persistente
del recién nacido. Rev Mex Pediatr [Internet]. octubre de 2009;76(5):11. Disponible en:
https://www.medigraphic. com/pdfs/pediat/sp-2009/sp095f.pdf
5.
Curtis
J, Kim G, Wehr NB, Levine RL. Group B strep-
tococcus, phospholipids, and pulmonary hypertension. J Perinatol
[Internet]. abril de 2011;31(Suppl
1):S24-8. Avai- lable from: https://www.ncbi.nlm.nih.gov/pmc/articles/ PMC3391007/
6.
Silvera F, Mele
A, Costas M, Viña M, Hermida
M, Di Lucci E, et al.
Hipertensión pulmonar e hipoxemia grave en recién nacidos.
Rev Soc Boliv
Pediatría [In- ternet]. enero de 2009;48(1):54-66.Disponible en: http://www.scielo.org.bo/scielo.php?script=sci_arttex- t&pid=S1024-06752009000100014
7.
Mir
Villamayor R. Oxigenoterapia en neonato un pro- blema aún no resuelto. Pediatría
Asunción [Internet]. diciembre
de 2016;43(3):237-45. Disponible en: http://scielo.iics.una.py/scielo.php?script=sci_arttex- t&pid=S1683-98032016000300237
8. Murphy JD, Rabinovitch M, Goldstein JD, Reid LM. The structural basis of persistent pulmonary hypertension of the newborn
infant. J Pediatr. junio de 1981;98(6):962-7. Avai- lable from: https://www.sciencedirect.com/science/article/ abs/pii/S0022347681806051
9.
Jone
PN, Ivy DD. Echocardiography in Pediatric Pul-
monary Hypertension. Front Pediatr [Internet]. 12 de no- viembre de 2014 [citado 23 de noviembre de 2022];2:124. Disponible
en: https://www.ncbi.nlm.nih.gov/pmc/articles/ PMC4228850/
10. Sola A, Golombek SG, Montes Bueno
MT, Lemus-Va- rela L, Zuluaga C,
Domínguez F, et al. Safe oxygen satu- ration
targeting and monitoring in preterm infants: can we avoid hypoxia and hyperoxia? Acta Paediatr Oslo Nor 1992. octubre de 2014;103(10):1009-18. Available from: https:// pubmed.ncbi.nlm.nih.gov/24838096/
11.
De Paoli AG, Clark RH, Bhuta T, Henderson‐Smart DJ. High frequency oscillatory ventilation versus conventional ventilation for infants with severe pulmonary dysfunction born at or near term. Cochrane Database Syst Rev [Internet].
8 de julio de 2009;2009(3):CD002974. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7004244/
12. Carrera Muiños S, Cano
Villalpando C, Fernández Ca- rrocera L, Cordero González
G, Corral Kassian
E, Barrera Martínez I, et al. Uso de óxido nítrico
inhalado en la hi- pertensión
pulmonar persistente del recién nacido. Perinatol Reprod Humana [Internet]. 1 de junio de 2016;30(2):69-74. Disponible
en: https://www.sciencedirect.com/science/ar- ticle/pii/S0187533716300383
13. Mourani PM, Sontag MK, Ivy
DD, Abman SH. Effects of long-term
sildenafil treatment for pulmonary hyperten-
sion in infants with chronic lung disease. J Pediatr. marzo de 2009;154(3):379-84, 384.e1-2.
Available from: https:// pubmed.ncbi.nlm.nih.gov/18950791/
14. Abman SH, Hansmann G, Archer SL, Ivy DD, Adatia I, Chung WK, et al. Pediatric Pulmonary
Hypertension: Gui- delines From the American Heart
Association and Ame- rican Thoracic
Society. Circulation. 24 de noviembre de 2015;132(21):2037-99. Available from:
https://www.aha- journals.org/doi/full/10.1161/CIR.0000000000000329
15.
Ivy DD, Abman SH, Barst RJ, Berger RMF, Bonnet D, Fleming TR, et al. Pediatric pulmonary
hypertension. J Am Coll
Cardiol. 24 de diciembre de 2013;62(25 Su- ppl):D117-126. Available from:https://pubmed.ncbi.nlm. nih.gov/24355636/
16. Balasubramaniam
V, Mervis CF, Maxey AM, Markham NE, Abman SH. Hyperoxia reduces bone
marrow, circu- lating, and lung
endothelial progenitor cells in the develo-
ping lung: implications for the pathogenesis of bronchopul- monary dysplasia. Am J Physiol Lung Cell
Mol Physiol. mayo de 2007;292(5):L1073-1084. Available from:
https:// pubmed.ncbi.nlm.nih.gov/17209139/
17. Kumar
VHS. Diagnostic Approach to Pulmonary Hyper- tension in Premature
Neonates. Child
Basel Switz. 24 de agosto de
2017;4(9):75. Available from: https://pubmed.
ncbi.nlm.nih.gov/28837121/
18. An HS, Bae EJ, Kim GB,
Kwon BS, Beak JS, Kim EK, et al. Pulmonary
hypertension in preterm infants
with bron- chopulmonary dysplasia. Korean Circ J. marzo de 2010; 40(3):131-6.
Available from: https://pubmed.ncbi.nlm.nih. gov/20339498/
19. Krishnan U, Feinstein JA,
Adatia I, Austin ED, Mullen MP,
Hopper RK, et al. Evaluation and Management of
Pulmonary Hypertension in Children with Bronchopul- monary
Dysplasia. J Pediatr [Internet]. 1 de septiembre de 2017 [citado
23 de noviembre de 2022];188:24-34. e1. Disponible en: https://www.jpeds.com/article/S0022- 3476(17)30650-9/fulltext
20. Abman SH, Collaco JM, Shepherd EG, Keszler M, Cue- vas-Guaman M, Welty SE, et al. Interdisciplinary Care of Children with Severe Bronchopulmonary
Dysplasia. J Pe- diatr. febrero
de 2017;181:12-28.e1. Available from: https:// pubmed.ncbi.nlm.nih.gov/27908648/
21. Villanueva D. Programa de Actualización Continua. PAC. Fed Nac
Neonatol México AC. 2016;4:82. ISBN:978-607- 443-552-8.
Disponible en: https://www.anmm.org.mx/pu- blicaciones/PAC/PAC_Neonato_4_L2_edited.pdf
![]() Diagnóstico y Manejo de Hipertensión Pulmonar Persistente en el Periodo Neonatal
en la Unidad de Neonatología.
Diagnóstico y Manejo de Hipertensión Pulmonar Persistente en el Periodo Neonatal
en la Unidad de Neonatología.






