PROTOCOLO MÉDICO
Manejo del paciente
con Hipertiroidismo en consulta externa de la Unidad Técnica de Endocrinología del Hospital Carlos Andrade
Marín.
Management of the patient with hyperthyroidism in the outpatient
clinic of the Technical Unit of Endocrinology of the Endocrinology Technical Unit of the Carlos Andrade Marín Hospital.

1. INTRODUCCIÓN
El hipertiroidismo es un trastorno caracterizado por el exceso de hormonas tiroideas. El déficit de yodo es un factor clave en dicha patología y en lugares con suficiencia del mismo se asocian a au toinmunidad tiroidea.
La prevalencia de hipertiroidismo mani fiesto varía del 0,2% al 1,3% en áreas con suficiencia de yodo, sin embargo, esto puede variar en cada
país por diferencias en umbrales
de diagnóstico, sensibilidad de ensayo y población se leccionada. Un reporte de The Third National Health and Nutri- tion Examination Survey (NHANES III) mostró que el hipertiroidismo manifiesto se presenta en 0,7% de la población general e hipertiroidismo subclínico en el 1,7%1,2.
En incidencia, la patología se asocia con la suplementación
de yodo, con la mayor frecuencia en áreas de deficiencias, por au mento de nódulos tiroideos en la población
anciana, teniendo a regiones de áreas montañosas como
América del Sur, África Central y
suroeste de Asia dentro de este grupo. Un meta aná- lisis de estudios europeos mostró una incidencia general de 50 casos
por 100000 personas/años1. En Ecuador, según los datos
del Instituto Nacional de Estadísticas y Censos (INEC) del 2017, se reportaron 157 casos de hipertiroidismo, de los cuales
la En- fermedad de Graves
(EG) fue la causa más común, seguida
por el bocio multinodular tóxico
(BMNT) y finalmente el adenoma tóxico
(AT) con una incidencia de 61 %, 24 % y 14 % respecti-
vamente3.
Los pacientes con esta patología tienen aumento de riesgo
com plicaciones cardiovasculares y mortalidad por todas las causas, siendo falla cardíaca uno de sus
principales desenlaces, así el diagnóstico precoz evita estos eventos, principalmente en pobla ción
de edad avanzada.
El presente protocolo se ha realizado para un correcto
trata- miento de esta patología
en el Hospital de Especialidades Carlos Andrade
Marín (HECAM).
Palabras clave: Hormonas Tiroideas; Hipertiroidismo; Enfer medad de Graves; Antitiroideos;
Oftalmopatía de Graves; En docrinología.
INTRODUCTION
Hyperthyroidism is a disorder characterized by an excess
of thyroid hormones. Iodine
deficiency is a key factor in this pathology and in places with iodine deficiency it is associated with thyroid autoimmunity. The prevalence of overt hyperthyroidism varies from 0,2% to 1,3% in
iodine-sufficient areas; however, this may vary from country to country due to differences in diag nostic thresholds, assay sensitivity, and
selected population. A report from The Third National Health
and Nutrition Examina
tion Survey (NHANES
III) showed that overt hyperthyroidism occurs in 0,7% of the general population and subclinical hyper
thyroidism in 1,7%1,2.
In incidence, the pathology is associated with iodine supplemen tation, with the
highest frequency in areas of deficiencies, due to increased thyroid nodules in the elderly population, having regions of mountainous areas such as South
America, Central Africa and Southwest Asia within this group. A meta-analysis
of
European studies showed an overall incidence of 50 cases per 100000 person/years1. In
Ecuador, according to data from the National Institute
of Statistics and Census (INEC)
in 2017, 157 cases
of hyperthyroidism were reported, of which, Graves’ di sease (GD) was the most common cause, followed by toxic mul tinodular goiter (BMNT) and finally
toxic adenoma (TA) with an incidence of 61 %, 24 % and 14 % respectively3.
Patients with this pathology have an increased risk of cardiovascular
complications and all-cause mortality, with heart failure being one of the main outcomes, so early diagnosis avoids these events,
mainly in the elderly population.
The present protocol has been carried out for the
correct treatment of this pathology at the
Carlos Andrade Marín Specialties
Hospital (HECAM).
Keywords: Thyroid Hormones;
Hyperthyroidism; Graves Disease;
Antithyroid Agents; Graves Ophthalmopathy;
Endocrino logy.
2. OBJETIVOS
2.1
Objetivo General
Establecer un protocolo
para normatizar los diferentes procedi
mientos para el diagnóstico y tratamiento del paciente con hipertiroidismo, según recomendaciones internacionales en la Unidad Técnica de Endocrinología del Hospital Carlos Andrade Marín.
2.2
Objetivos específicos
Establecer el manejo del paciente con hipertiroidismo según las últimas
indicaciones de guías internacionales.
Individualizar el tratamiento del paciente según etiología y comorbilidades.
Evitar complicaciones severas asociadas a hipertiroidismo
sin tratamiento.
Evitar complicaciones relacionadas al tratamiento administrado.
3. ALCANCE
El presente protocolo clínico será ejecutado por el
personal médico ante el diagnóstico de hipertiroidismo en pacientes atendidos en la Unidad Técnica
de Endocrinología, nivel III de aten ción médica, del Hospital de
Especialidades Carlos Andrade Marín (HECAM).
4. MARCO TEÓRICO
4.1 Definiciones
Al hablar de exceso de función tiroidea
se debe establecer la diferenciación de
sus términos. Tirotoxicosis se refiere a las manifestaciones fisiológicas clásicas de un grupo de trastornos caracterizados por cantidades excesivas
de hormona tiroidea, esto puede tener etiologías de tipo viral,
exógeno, inflamatorio, etc. Hipertiroidismo se refiere a los desórdenes causados por la síntesis
y liberación sostenida y prolongada de hormonas por la glándula tiroides, teniendo aquí como principal ejemplo la enfermedad
de Graves Basedow. Entender el origen
es importante ya que esto define el tratamiento3,4.
4.1.1 Hipertiroidismo subclínico.
Se caracteriza por la supresión de valores de hormona
estimu lante de la tiroides (TSH) a
menos de 0,4 mUI/L con valores de
triyodotironina libre (FT3) y tiroxina libre (FT4) dentro de la normalidad, conocida como forma leve.
Su causa es similar a todos
los tipos de hipertiroidismo manifiesto aunque la causa
exógena por ingesta excesiva de hormona tiroidea es más frecuente. Las
consecuencias clínicas de esta patología incluyen la progresión a hipertiroidismo manifiesto, principalmente con valores de TSH menores a 0,1mUI/L que se
considera ya una forma severa,
complicaciones cardiovasculares, esto en base
de diversos meta análisis que muestran mayor riesgo de fibri lación auricular, insuficiencia cardíaca, muerte por enfermedad coronaria y muerte por cualquier causa5.
Se han descrito también mayor riesgo de fracturas
y pérdida de masa ósea y mayor
riesgo de demencia
en personas mayores
de 65 años. En base a esto se recomienda el tratamiento en pacientes de edad avanzada o con forma severa5,6.
4.1.2 Enfermedad de Graves
Es el trastorno más frecuente en áreas con suficiencia de
yodo llegando a un 70% y en áreas de deficiencia en un 50% con una incidencia de 15-30 casos por 100 000 habitantes en países eu ropeos2. Afecta a nivel global a 2% de
mujeres y 0,2% de hom bres con una relación 10:1, con pico de
edad entre los 20 y 50 años. En factores de riesgo existe
una combinación de factores genéticos y ambientales; predisposición genética ha sido obser vada
en gemelos monocigóticos pero también con una baja pe netrancia, también otros factores como
sexo femenino, estrés, tabaco,
drogas, infecciones, agentes inmuno moduladores y la microbiota han sido asociados. Así su etiología se considera multifactorial, con desenlace autoinmune, partiendo de una pér- dida de la inmunotolerancia y el desarrollo de auto-anticuerpos que estimulan las células foliculares
tiroideas al unirse al receptor de TSH (TSHR). Sus manifestaciones engloban un
sín drome caracterizado por una
tiroides agrandada e hiperactiva, alteración ocular
como Oftalmopatía de Graves (OG) y dermo patía localizada (mixedema pre tibial)7,8.
La OG se presenta en un 25%, es clínicamente significativo en el 5% de pacientes y es causado
por inflamación retro
orbitaria llevando
a disrupción de los músculos extra
orbitarios y acumu
lación de glicosaminoglicanos, causando edema, esto causado por la presencia de TSHR en los tejidos. La dermopatía es menos frecuente y se presenta en un 1-4% de
pacientes con oftalmo- patía. Acropaquia es otra manifestación extra
tiroidea que se da con menos frecuencia. La presencia de anticuerpos contra
el re ceptor de TSH (TRAbs) tiene un 97% de sensibilidad (S) y 99% de especificidad (E) para EG9.
4.1.3 Nódulo tóxico.
Se trata de un tumor benigno monoclonal con la capacidad de producir triyodotironina (T3) y tiroxina
(T4) de forma autónoma, los síntomas aparecen cuando existe un número suficiente de folículos autónomos, generalmente lesiones de más de 3 cm. El riesgo
de malignidad es menor al 1%. Se observa más en pa cientes entre 30-60 años y más común en el sexo femenino con proporción 6:1 a 15:1, con mayor prevalencia en áreas de baja
ingesta de yodo. La base patogénica en el 60-80% de casos es una mutación somática puntual en el gen
del TSHR que producen una activación constitutiva de la proteína G de membrana, ocasionado una expansión clonal de las células
foliculares afec tadas
y su hiperfunción. En ⅓ de los casos no se encuentra y se atribuyen factores ambientales9.
4.1.4 Bocio multinodular tóxico.
Es el aumento progresivo y nodular de la tiroides en
ausencia de autoinmunidad, malignidad o inflamación, con causales ge néticas y ambientales, siendo
el más importante la insuficiencia de yodo. La prevalencia es mayor en el sexo femenino, con edad mayor a 60 años, con una incidencia de 18
casos x 100 000 vs 1,5 x 100 000 en áreas con suficiencia. Patológicamente las áreas de funcionalidad pueden tener un principio similar al AT, sin em bargo difieren de este en el que el
origen no es monoclonal, se han encontrado
diferentes mutaciones en la misma glándula. Un bocio importante puede causar disfonía,
disfagia y disnea por compresión de
estructuras por lo que la opción quirúrgica se
considera de inicio
en estos casos9,10.
4.1.5 Hipertiroidismo en el embarazo.
El perfil tiroideo en el embarazo tiene modificaciones por
el efecto de hCG (Gonadotrofina coriónica humana) que actúa en los receptores de TSH de la glándula
ejerciendo efecto similar.
Así existe una disminución fisiológica de los valores de TSH. Las etiologías de hipertiroidismo en la
gestación son varias, siendo la EG y la tirotoxicosis gestacional transitoria (TGT) las más frecuentes. TGT afecta al 1-5% de embarazos en etapa tem prana y no es causada por enfermedad tiroidea, por lo que no re- quiere droga antiroidea (DAT).
Su clínica está asociada con los niveles de hCG que aumentan a la semana 7 de gestación, la sin tomatología disminuye junto con el descenso
de la misma entre la semana 14 y 20, formas severas se
asocian con hiperémesis gravídica. En EG puedo tener aumento de síntomas
en el primer trimestre por el mismo efecto del hCG en la glándula
tiroides y el aumento de TRAb en el primer trimestre, además que valores
altos previo embarazo
se asocia a mayor riesgo
de recaída. Si la paciente tuvo antecedente previo de EG y
recibió tratamiento específico, se recomienda medición
de TRAb al inicio del embarazo y en caso de estar elevado repetirlo
entre la semana
18-22. Valores
de TRAb 3 veces por encima del rango normal sugieren embarazo de riesgo y se requiere un
seguimiento más cer- cano11,12.
4.2 Manifestaciones Clínicas
Los síntomas de hipertiroidismo pueden
variar dependiendo de su etiología
y el grado de producción de hormonas, yendo
desde una forma subclínica
hasta una tormenta tiroidea. Se ha visto que
el efecto adverso implica diferentes esferas. Un estudio de casos
y controles en más de 300 pacientes demostró que existe
una disminución de leptina, lipoproteína de alta densidad (HDL) y lipoproteína de baja densidad
(LDL) en este grupo, junto
con niveles altos de insulina
en ayunas, resistina, adiponectina y HOMA. (p <0,05)13. Una revisión sistemática en más de 200 000 pacientes mostró que hay mayor probabilidad
de diagnóstico de depresión
clínica tanto en rango clínico
(OR 1,67 IC 1,49
- 1,93), como subclínico (OR 1,36 IC 1,06-1,74). Los mecanismos
causantes parecen incluir
mecanismos neurobiológicos, como niveles de 5 Hidroxitriptamina (5HT), hipercortisolismo, citocinas inflamatorias y polimorfismo
de deiodinasas, especí ficamente tipo 2 (DIO2)
o el transportador de hormona
tiroidea OATP1C114. La enfermedad ocular tiroidea se puede presentar
en pacientes con función normal. Una revisión en más de 900 estudios mostró que la prevalencia de la misma es de 10,35%
en hipotiroidismo, 7,9% en eutiroidismo y en 86% de pacientes con hipertiroidismo. OG y EG son patologías que involucran al sis- tema inmune, pero son dos condiciones separadas9.
A nivel cardiovascular en el corazón se ha visto acción en
el cardiomiocito, regulando la contractibilidad y la función
sistó lica y un efecto
inotrópico directo, regulando positivamente la
expresión génica de receptores B1 adrenérgicos. El efecto cro notrópico
se manifiesta por aumento de taquicardia en 5-15% de pacientes e incremento de riesgo de fibrilación auricular. A nivel vascular se ha visto disminución de
resistencia vascular sistémica por aumento
en la producción de óxido nítrico. Esta com binación de efectos lleva a un aumento del gasto cardiaco de 50 a 300%.
Si esto no es tratado,
puede llevar a signos y síntomas de falla
cardíaca consecuencia de hipertrofia ventricular izquierda y arritmias.
También se ha encontrado asociación con la patogénesis de hipertensión pulmonar y falla cardíaca
derecha con una prevalencia del cuadro en 43-44%15.
A nivel metabólico se ha visto intolerancia a la glucosa debido a factores como aumento
de glucogenólisis, gluconeogénesis, in- cremento
de absorción intestinal de glucosa con cetogénesis secundaria y lipolisis alterando así la
secreción insulínica por la célula beta16.
Otra manifestación menos frecuente
es la parálisis periódica hipokalémica, que afecta principalmente a jóvenes de origen asiá
tico entre 20-40 años. Se caracteriza por ataques de parálisis aguda e hipokalemia asociada a
hipertiroidismo. Los síntomas se presentan
en la mañana o luego actividad física
intensa o alta ingesta de carbohidratos17.
4.3 Diagnóstico
Requiere evaluación de las manifestaciones clínicas (Tabla
1), laboratorio e imágenes.
4.3.1
Manifestaciones clínicas.
Tabla 1. Manifestaciones clínicas de hipertiroidismo
|
Sistema
|
• Síntomas
|
Signos
|
|
Constitucionales
|
• Ansiedad
|
• Pérdida de peso
|
|
|
• Intolerancia al calor
|
|
|
|
• Hipercinesia
|
|
|
|
• Insomnio
|
|
|
|
• Fatiga
|
|
|
|
• Pérdida de peso
|
|
|
|
• Aumento de apetito
|
|
|
Sistema Nervioso Central
|
• Labilidad Emocional
|
• Temblor
|
|
|
• Articulación rápida de palabras
|
• Reflejos profundos con fase de relajación rápida
|
|
|
• Irritabilidad
|
|
|
|
• Nerviosismo
|
|
|
Cardiorrespiratorio
|
• Disnea
|
• Arritmias (fibrilación auricular)
|
|
|
• Palpitaciones
|
• Incremento de la presión de pulso
|
|
|
• Dificultad respiratoria
|
• Hipertensión arterial sistólica
|
|
Gastrointestinal
|
• Diarrea o aumento de número de deposiciones
|
• Sensibilidad abdominal
|
|
|
• Nausea y vomito
|
|
|
Reproductivo
|
• Ginecomastia
|
• Disturbios menstruales
|
|
Linfático y hemático
|
|
• Hepatomegalia y esplenomegalia
|
|
|
|
• Hiperplasia de ganglios linfáticos
|
|
|
|
• Anemia normocítica normocrómica
|
|
|
|
• Linfático y hemático
|
|
Músculo esquelético
|
• Debilidad muscular
|
|
|
Piel
|
• Pelo fino y delgado
|
• Onicolisis
|
|
|
• Alopecia
|
• Dermatopatía (0,5-4%)
|
|
|
• Sudoración
|
• Acropaquia (1%)
|
|
|
• Piel húmeda
|
|
Fuente: De Leo S, Lee SY, Braverman LE. Hyperthyroidism. The Lancet. 2016; 388 (10047): 906–18. Available from: https://www.ncbi.nlm.nih.gov/pmc/ articles/PMC5014602/
4.3.2 Laboratorio:
Función tiroidea:
• TSH es una glucoproteina de 28 kDa, con vida media de 50 - 80 minutos. Su producción y liberación está dada por acción de la hormona liberadora de tirotropina
(TRH) o por una disminución de T3 y T4 y su inhibición por un incremento de las mismas.
• FT4
es la forma activa de hormona tiroxina
que entra en los tejidos
para mejorar su precisión.
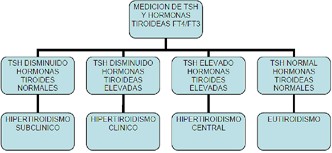
• Un nivel alto de hormonas tiroideas
(T4L y T3L) con una TSH baja significa
un hipertiroidismo o una tirotoxicosis.
• En el caso de formas hipofisarias se encuentran la T4L y T3L altas con TSH alta.
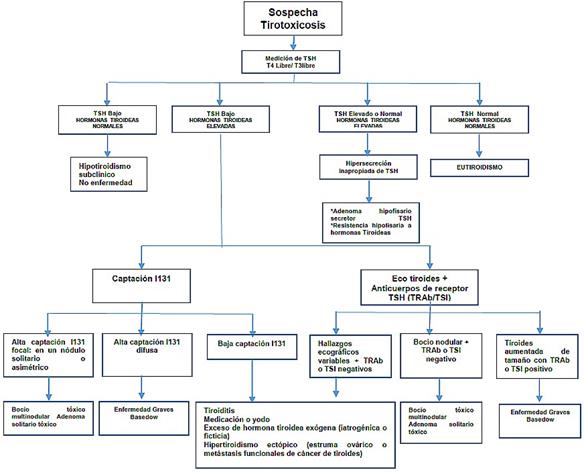
Gráfico 1. Algoritmo diagnóstico inicial de tirotoxicosis
Fuente. Elaborado por los autores, Unidad técnica de Endocrinología.
•
Anticuerpos anti receptor de TSH (TRAb). Este anticuerpo puede estar presente
en pacientes en individuos normales y Hashimoto (6-60%), sin embargo su
presencia en pacientes hipertiroideos es altamente específica para EG. Títulos elevados
se han asociado con mayor probabilidad de recurrencia y fracaso de tratamiento
oral 18.
• Complementarios:
•
Biometría hemática: leucocitosis o leucopenia
•
Enzimas hepáticas: aspartato aminotransferasa (AST) /alanino
aminotransferasa
(ALT) importantes a evaluar previo
tratamiento
con droga anti tiroidea
•
Creatinina
•
Glucosa
4.3.3 Imagen
•
Eco de tiroides: Alta sensibilidad para detección de nódulos y EG. Un aumento
en su vascularización sugiere hiperfunción tiroidea mientras que una tiroiditis
tiene flujo y vascularidad disminuidos.
•
Gammagrafía tiroidea: Solicito en caso de requerir diagnóstico diferencial de
otras causas de tirotoxicosis. Una gammagrafía captante difusa es
característico de EG. Una captación localizada sugiere adenomas tóxicos en
presencia de nódulos. Una gammagrafía no captante sugiere tiroiditis19.
•
Punción de nódulo tiroideo: En caso de tener nódulo con características de
sospecha o nódulo frío/ no captante en la gammagrafía.
•
Tomografía de cuello: se recomienda en caso de bocio o presencia de síntomas
compresivos.
4.4
Tratamiento
En el tratamiento del hipertiroidismo existen
3 opciones: Droga
anti tiroidea (DAT),
yodo radioactivo y cirugía.
4.4.1 Drogas
Tionamidas
Se tiene dos opciones principales: Propiltiouracilo (PTU) y Me timazol (MMI),
con equivalencia de 15-20:1 entre
los mismos. MMI tiene mayor duración que permite una
administración única diaria aunque
dividida se ha visto efectiva en casos graves10.
MMI se prefiere en la terapia de elección inicial, ex- cepto en embarazo donde se recomienda PTU en el primer trimestre por teratogenicidad.
Mecanismo de acción:
Inhiben la síntesis
de T4 y T3 dentro
de las células foliculares al interferir en la organificación y el acoplamiento de las yodotironinas y además
bloqueo de la pe roxidasa tiroidea,
responsable de la yodación de productos tiro sinas en la tiroglobulina. Adicionalmente a nivel periférico PTU inhibe la conversión de T4 en T3 por
acción en la deiodinasa tipo 1 (DI1)9.
Dosificación: se recomienda según las indicaciones de la ATA (Americn Thyroid
Association) 2016 (Tabla 2) en base al valor de FT4 por sobre el límite superior
de la normalidad (LSN)10.
Tabla 2. Dosis de
medicación recomendada según FT4.
|
Elevación T4 libre
|
Metimazol (mg/día)
|
Propiltiouracilo (mg/día)
|
|
1 a 1.5 LSN
|
5-10
|
100-200
|
|
1.5 a 2 LSN
|
10-20
|
200-400
|
|
2 a 3 LSN
|
30-40
|
600-800
|
*Dosis máxima de
medicación recomendada: MMI 60mg/dia y PTU 1200mg/dia
Fuente:
American Thyroid Association ATA Guidelines. 2016. Available from:
https://www.thyroid.org/professionals/ata-professional-guidelines/
Seguimiento y
manutención: De inicio el
control es cada 4 -6 semanas hasta obtención de eutiroidismo o entrar en
hipotiroidismo.
Tiempo de
tratamiento: 12-18 meses. Una
revisión sistemática demostró que la tasa de remisión en adultos no mejora con
un periodo mayor a este tiempo10.
Eficacia: La mayoría de pacientes normaliza el perfil
tiroideo pero existe recidiva, esto principalmente en el primer año de suspensión
hasta en un 75% y menos del 10% luego de 18 meses.
Se considera remisión
en EG la presencia de niveles normales de perfil tiroideo 12 meses luego de la
suspensión de tionamidas. Un metanálisis mostró alta tasa de recidiva a largo
plazo de tionamidas (57%) en comparación con yodo radiactivo (RAI) 15% (OR
6,25) o cirugía 10% (OR 9,09). En estos casos se puede optar por RAI o
cirugía9.
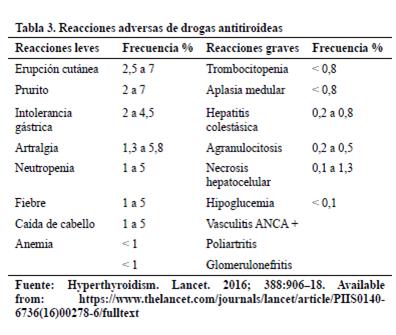
Efectos adversos: Se observan con más frecuencia en los
primeros 3- 6 meses de tratamiento y parecen ser dosis dependiente con MMI
(Tabla 3). Las reacciones leves ocurren en un 5%. La agranulocitosis y
hepatotoxicidad siendo las reacciones graves más importantes.
Agranulocitosis.- Se caracteriza por el contaje absoluto de
granulocitos < 500/mm. La sintomatología se asocia con infecciones
de orofaringe. Su
presentación es súbita por lo que no se recomienda monitoreo rutinario de
biometría hemática (BH) pero es importante realizarla antes del inicio del
tratamiento, ya que la leucopenia es un hallazgo en EG. El tratamiento se basa en
la suspensión del medicamento y la hospitalización, de ser necesario con uso de
antibióticos de amplio espectro de acuerdo a la clínica20.
Hepatotoxicidad.- En el caso de MMI su causa es colestásica y
en el caso de PTU por lesión hepatocelular y hepatitis fulminante. Ocurre
generalmente en los primeros 3 meses de tratamiento. El tratamiento de inicio
es suspender el medicamento. Es importante evaluar la función hepática antes
del tratamiento ya que puede existir elevación de transaminasas (AST y ALT) al
diagnóstico. Se considera que con valores 3 veces el LSN se
debe evitar y
suspender el uso de tionamidas 9.
Betabloqueantes
(BB).- Actúan a nivel del
sistema nervioso simpático. En dosis altas bloquean la conversión de T4 a T3.
El propranolol es la droga más utilizada en dosis de 40-120 mg /día.Como
alternativa se pueden usar B1 selectivos (Atenolol 50-100 mg/día). Se
recomienda su administración en pacientes ancianos con tirotoxicosis y factores
de riesgo cardiovascular o frecuencia cardiaca mayor a 90 en reposo y en
general a todos los pacientes con tirotoxicosis21.
4.4.2 Yodo
radioactivo.- Puede ser
considerado como terapia inicial o terapia definitiva de segunda línea. El
objetivo es controlar el hipertiroidismo y llevar al paciente a hipotiroidismo.
Se pueden utilizar dosis fijas o dosis calculada en milicuries (MCI) por gramo
de tejido tiroideo, la eficacia es similar pero también depende de la dosis
administrada.
RCT han demostrado
éxito en un 74% con dosis de 10MCI y 84% con dosis de 15 MCI. Luego de recibir
la terapia el paciente mejora la función tiroidea y síntomas en 4 a 8 semanas, llegando
a hipotiroidismo en un 40% a las cuatro y 80% a las 8 semanas. Hasta un 40% de
pacientes pueden requerir una segunda dosis de RAI, esto se evalúa 6 meses
después de la primera dosis de RAI ya que el TSH puede demorar en normalizar
9,10,20. En caso de hipertiroidismo severo se recomienda compensación con ATD previo
tratamiento con RAI.
Complicaciones:
• Hipotiroidismo:
puede ser permanente o transitorio, dependeráde la dosis utilizada. El
tratamiento es el uso de Levotiroxina (LT4).
• Tiroiditis por
radiación: Ocurre en 3%. Se presenta dolor cervical anterior y exacerbación
del hipertiroidismo por liberación de T3 y T4 a la sangre.
• Oftalmopatía de
Graves: RAI puede exacerbar
esta patología, siendo el tabaco uno de los principales factores de riesgo.
Esto puede ser prevenido con el uso de corticoides, recomendados en paciente
fumadores; oftalmopatía activa leve o moderada, hipertiroidismo grave,
TRAb alto. Es
importante llegar al eutiroidismo antes del RAI. Se ha visto que el
hipotiroidismo también puede empeorar la patología ocular, por lo que se
recomienda iniciar de forma temprana LT420.
Preparación para RAI:
• Se recomienda el uso de tionamidas
hasta llegar el eutiroidismo.
• Se recomienda MMI sobre PTU por el
aparente efecto radioprotector del mismo. MMI se debe suspender 7 días antes y reiniciar
7 días después de RAI.
Contraindicaciones
•
Embarazo
•
Lactancia
•
Oftalmopatía grave
•
Planificación de embarazo menor a 6 meses por RAI
4.4.3 Cirugía
Las ventajas de la cirugía
incluyen la rápida
normalización del perfil tiroideo y mejora de síntomas
compresivos. Los riesgos están
asociados a la cirugía y complicaciones los cuales son menores con un cirujano experimentado (> 100 cirugías/año)9. La cirugía se recomienda también
en presencia de nódulos sos pechosos.
Una revisión sistemática demostró que el riesgo de malignidad en hipertiroidismo es de un 8,5 %, siendo el riesgo mayor en presencia de nódulos (19,8%) vs sin nódulos 8,7% con mayor frecuencia en paciente son AT y BMNT comparado
con EG (6,9 Y 12% vs
5%)22,23.
Preparación para Cirugía
• Se recomienda tionamidas y obtener en
lo posible eutiroidismo antes de la cirugía (4-8 semanas).
• 5-10 días previo cirugía: yoduro de
potasio (Lugol) 5-7 gotas cada 8
horas. El objetivo es disminuir el flujo sanguíneo y pérdida durante
la cirugía.
Complicaciones
• Lesión de nervio laríngeo recurrente
• Hipoparatiroidismo transitorio o permanente
• Sangrado
•Hipotiroidismo
5. INVOLUCRADOS
Tabla 4. Personal que participa en el protocolo

Cargo Responsabilidad
/ Autoridad / Funciones
Jefe de la Unidad Técnica de Garantizar
la aplicación del protocolo
Endocrinología.
Médicos Especialistas, Cumplir
lo establecido en el protocolo.
Médicos Residentes
Asistenciales y Postgradistas
de la Unidad Técnica de
Endocrinología.
Cumplir lo establecido en el protocolo.
Jefa de Enfermeras de Garantizar
la aplicación del protocolo.
la Unidad Técnica de
Endocrinología.
Enfermeras de la Unidad Cumplir
lo establecido en el protocolo
Técnica de Endocrinología.
_____________________________________________________________
Fuente. Unidad Técnica de
Endocrinología HECAM
6. ACTIVIDADES
•
Paciente acude a consulta externa de endocrinología
•
Realizamos historia
clínica y examen físico del paciente en búsqueda de signos y síntomas de hipertiroidismo
•
Evaluamos exámenes de laboratorio para confirmar el diag nóstico
• Evaluamos ecografía cervical para evaluación de nódulos
•
Evaluamos gammagrafía tiroidea para diagnóstico diferen cial de etiología
• En base a los resultados observados decidimos tratamiento
6.1 Enfermedad de Graves Basedow
Tratamiento Enfermedad de Graves Basedow paciente adulto
6.1.1
Drogas antitiroideas.-
Inicial:
• Iniciamos tionamidas con dosis óptima de medicación:
•
Metimazol como primera opción de acuerdo a valores de FT4 (Tabla 3)
•
Propiltiouracilo como segunda opción según valores de FT4 (Tabla 3)
• Se inicia BB para control de síntomas adrenérgicos.
•Se informa al paciente de síntomas de alerta a reacciones ad- versas de medicación (Tabla
4).
•
Ante efectos adversos de DAT severos el medicamento será suspendido inmediatamente y el paciente será hospitalizado.
Seguimiento:
•
Control en 4 semanas
con: TSH; FT4, Biometría hemática; AST; ALT;
Bilirrubinas.
•
Perfil tiroideo con mejoría: mantengo tratamiento a dosis óptima.
• Perfil tiroideo sin mejoría; optimizar dosis.
• Control en 4 semanas con: TSH, FT4, FT3.
• Perfil tiroideo normal: mantengo dosis.
•
Perfil tiroideo
en hipotiroidismo: suspenso
tionamidas e inicio
LT4.
•
Recaída de la enfermedad: reinicio ATD y planificó trata-
miento definitivo.
• Perfil tiroideo sin mejoría.
•
Con dosis óptima de DAT: Tratamiento con I131.
•
Deseo de embarazo en menos de 6 meses:
cirugía.
Aspectos a considerar en el tratamiento:
• TRAb elevado: en paciente con títulos
elevados de TRAb sin mejora
de perfil tiroideo con dosis eficaz de medicación indica menor probabilidad de remisión y se debe considerar alternativas terapéuticas según comorbilidades y prefe rencia
del paciente y evitar inercia
terapéutica:
• Yodoterapia
•
Cirugía
• Paciente gestante
• Primer trimestre
• PTU como terapia estándar
• Segundo y tercer trimestre:
• Metímazol como terapia estándar
• En caso de no obtener
un control adecuado
•
Cirugía: se recomienda en el segundo
trimestre del emba razo para disminuir riesgo
de aborto
• Oftalmopatía de Graves: En oftalmopatía moderada o severa se considera la cirugía como
opción de preferencia sobre RAI para evitar empeoramiento de la misma.
• Nódulos tiroideos: en caso de nódulos con características de sospecha, se investigará de acuerdo a las recomendaciones internacionales de nódulo tiroideo. Un resultado de punción aspiración con aguja fina (PAAF) indeterminado o positivo para malignidad será indicativo de tratamiento quirúrgico.
6.1.2 Yodoterapia
Preparación de pacientes de para RAI
Se recomienda obtener eutiroidismo en
pacientes que tengan riesgo de
complicaciones (comorbilidades o FT4 2-3 veces
LSN).
• Se
usarán antitiroideos MMI o PTU. Los mismos se deben
suspender 7 días antes y reiniciar 7 días después del trata- miento.
• El
uso de BB se recomienda previo tratamiento para dismi nuir complicaciones por empeoramiento de RAI.
• En sexo femenino se pedirá prueba de
embarazo 48 horas antes de la administración de RAI
Seguimiento posterior a RAI
• El primer control se realizará 6 semanas posteriores a RAI.
•
Se evaluará
FT4. TSH puede permanecer suprimido
en el primer mes de tratamiento
• Si el paciente está en hipotiroidismo, se iniciará LT4 .
• Si el paciente persiste hipertiroideo o con mínima
respuesta a los 6 meses, se puede optar por nueva dosis de RAI o ci- rugía.
6.1.3
Cirugía
Preparación de pacientes para cirugía
• Se buscará en lo posible eutiroidismo
antes de la cirugía para evitar
complicaciones en la misma con el uso de DAT y
BB
•
Se administra 5-10 días antes de la cirugía: yoduro de po- tasio
(LUGOL) 5-7 gotas 3 veces por día.
•
El procedimiento debe ser realizado
por un cirujano expe rimentado.
•Se iniciará Levotiroxina luego de la cirugía y el seguimiento será en consulta externa en 4-8 semanas.
6.2 Nódulo tóxico o Bocio multinodular tóxico
Estas patologías no tienen origen autoinmune, por lo que el
uso de DAT es transitorio hasta el obtener eutiroidismo y
dar tratamiento
definitivo: RAI o cirugía, ya que suspender DAT causará una recaída
6.2.1
Yodoterapia
Preparación de pacientes de para RAI.
• Se recomienda obtener
eutiroidismo en pacientes
que tengan riesgo de complicaciones
(comorbilidades o FT4 2-3 veces LSN)
• Se usarán antitiroideos MMI o PTU. Los mismos
se deben suspender 7 días antes y reiniciar 7 días
después del trata- miento.
• El uso de BB se recomienda previo para disminuir compli caciones por empeoramiento
de RAI.
• En sexo femenino se pedirá prueba de
embarazo 48 horas antes de la
administración de RAI.
Seguimiento posterior a RAI:
• El primer control se realizará 6
semanas posterior a RAI.
• Se evaluará FT4. TSH puede permanecer
en el primer mes de tratamiento
• Si el paciente está en
hipotiroidismo, se iniciará LT4.
• Si el paciente persiste hipertiroideo
o con mínima respuesta a los 3 meses, se puede optar por nueva dosis de RAI o
cirugía.
Consideraciones
• Tasa de falla de remisión con RAI en
BMNT 15%.
• Riesgo de persistencia o recurrencia
con RAI en AT: 0-30%.
• Riesgo de falla terapéutica 0-3%. Esto según procedimiento: tiroidectomía total
o parcial.
Tabla 5. Recomendaciones de tratamiento en Enfermedad de Graves
Tionamidas Radioyodo Cirugía

Alta probabilidad de remisión. Planificación de embarazo mayor a 6 meses. Planificación de embarazo
menor a 6 meses. Riesgo quirúrgico. Riesgo quirúrgico. Sospecha de malignidad.
No acceso
a cirujano experimentado. No acceso a cirujano experimentado. Hiperparatiroidismo
coexistente.
Irradiación anterior de cuello. Irradiación anterior de cuello. Bocios
compresivos o mayores a 80 gramos.
Oftalmopatía moderada o severa. Contraindicación de tionamidas. Oftalmopatía moderada
o severa.
Ancianos o expectativa de vida corta. Fracaso de ATD. Contraindicación
o fracaso de ATD o
radioyodo.
Elección del paciente. Elección del paciente. Elección del paciente.
Fuente: American Thyroid Association ATA Guidelines. 2016. Available from: https://www.thyroid.org/professionals/ata-professional-guidelines/
6.2.2 Cirugía
Preparación de pacientes para cirugía.
• Se buscará eutiroidismo antes de la
cirugía para evitar complicaciones en la misma con el uso de DAT y BB.
• No
se administra yodo en estos pacientes previo
cirugía ya que puede empeorar el hipertiroidismo.
• El procedimiento debe ser realizado
por un cirujano expe rimentado.
• Procedimiento debe ser realizado por
un cirujano experimentado
• Se iniciará Levotiroxina luego de la
cirugía y el seguimiento será en consulta externa en 4-8 semanas.
Consideraciones
• Riesgo de falla terapéutica 0-3%. Esto
según procedimiento: tiroidectomía total o parcial.
• Crisis Tirotóxica
• Emergencia endocrina que requiere
tratamiento multimodal con BB, DAT, yodo inorgánico, corticoides, soporte vital
y manejo por terapia intensiva.
• Se confirmará mediante escala de Burch
y Wartofsky (Tabla 6).

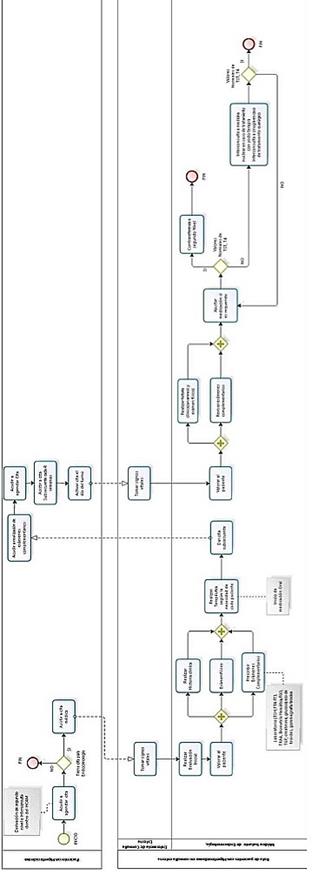
7. Ruta de Paciente

8. Complicaciones
y/o Desviaciones del protocolo
Si el paciente se encuentra con sintomatología severa,
deberá ser hospitalizado para manejo
interno hasta conseguir un buen control.
En caso de crisis tirotóxica el manejo requiere terapia intensiva.
9. Anexos.
Gráfico 2. Algoritmo diagnóstico en paciente con tirotoxicosis
Elaborado por. Adaptado por los autores, Unidad Técnica de Endocrinología.
Fuente: De Leo S, Lee Sy, Braverman L. Hyperthyroidism. Lancet. 2016; 388:906–18. Available from: https://www.thelancet
Gráfico 3. SGC-EC-FL-002 Ruta del paciente con Hipertiroidismo en consulta externa
ABREVIATURAS
TSH: Hormona estimulante de la tiroides; T3:
triyodotironina; T4:
tetrayodotironina; TRH: Hormona liberadora de tirotro- pina; DIO2: Deionidasa tipo 2; DIO1: Deionidasa tipo 1; EG: Enfermedad de Graves; BMNT: Bocio
Multinodular tóxico; AT: Adenoma Tóxico; DAT: Drogas anti tiroideas; TRAb: An- ticuerpo anti receptor de TSH; TGT:
Tirotoxicosis gestacional transitoria;
TSHR: Receptor de TSH; OG: Oftalmopatía de Graves;
hCG: Gonatrofina coriónica humana; PTU: Propiltiu- racilo; MMI: Metimazol; BB: Betabloqueantes; RCT: Rastreo corporal total; RAI: Radio yodo; MCI:
Milicuries; BH: Bio- metría Hemática; LT4: Levotiroxina: LSN: Límite superior
de la normalidad; ATA: Asociación Americana de la Tiroides; HECAM: Hospital de Especialidades Carlos Andrade Marín
CONTRIBUCIÓN DE LOS AUTORES
KG: Concepción y diseño del trabajo, Recolección / obtención de resultados, Análisis
e interpretación de datos, Redacción
del manuscrito, Revisión
crítica del manuscrito, Aprobación de su versión
final, Rendición de cuentas. (ICMJE). CC, DG: Re- visión crítica del manuscrito, Aprobación de su versión final, Rendición de cuentas. (ICMJE). MR, GV:
Recolección / ob- tención de
resultados, Aprobación de su versión final, Rendi- ción de cuentas. (ICMJE). CR, Redacción del manuscrito, Re- visión crítica del manuscrito,
Aprobación de su versión final, Rendición
de cuentas. (ICMJE).
DISPONIBILIDAD DE DATOS Y MATERIALES
Se utilizaron recursos bibliográficos de uso libre y
limitado. La información recolectada
está disponible bajo requisición al autor
principal.
APROBACIÓN DE GERENCIA GENERAL
Y DIRECCIÓN TÉCNICA
El protocolo médico fue aprobado
por pares y por las máximas autoridades.
CONSENTIMIENTO PARA PUBLICACIÓN
La
publicación fue aprobada por el Comité de Política Editorial de la Revista Médico Científica CAMbios del HECAM en Acta 004 de fecha 29 de septiembre de 2023.
FINANCIAMIENTO
Se trabajó con recursos propios de los
autores.
CONFLICTOS DE INTERÉS
Los autores reportaron no tener ningún conflicto de
interés, personal, financiero, intelectual,
económico y de interés cor- porativo.
AGRADECIMIENTOS
Al Equipo
Editorial de la Revista Médico
Científica CAMbios.
REFERENCIAS BIBLIOGRÁFICAS
1. Taylor P, Albrecht D, Scholz A,
Gutierrez-Buey G, La- zarus J, DAyan
C, Okosieme O. Global epidemiology of hyperthyroidism and hypothyroidism. Nature Reviews En- docrinology.
14, 301–316 (2018). Availablefrom: https:// www.nature.com/articles/nrendo.2018.18
2. De Leo S, Lee Sy, Braverman L. Hyperthyroidism. Lancet. 2016;388:906–18.
Available from:
https://www.thelancet. com/journals/lancet/article/PIIS0140-6736(16)00278-
6/fu- lltext
3. Narváez Iñahuazo DF. Descripción y
Análisis de Signos y Síntomas en
Pacientes con diversos tipos de Hipertiroi- dismo
y Modalidades de Tratamiento practicados en el
Servicio de Endocrinología del Hospital Eugenio Espejo entre Enero del 2015 a Diciembre del 2018 Quito: [Tesis]; 2015 – 2018. Disponible en: http://repositorio.puce.edu.ec/ handle/22000/17489
4. Davies
TF, Laurberg P, Bahn RS. Hyperthyroid Disorders. Williams Textbook of
Endocrinology (pp. 369-415). DOI 10.1016/B978-0-323-29738-7.00012-5. ISBN: 978-0- 323- 29738-7
5. Biondi B, Cooper DS. Subclinical
Hyperthyroidism. The New England
journal of medicine. 379. 1484. DOI: 10.1056/ NEJMcp1709318. Available from: https://www. nejm.org/doi/10.1056/NEJMcp1709318?url_ver=Z39.88- 2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%20 0pubmed
6. Zhyzhneuskaya S, Addison C,
Tsatlidis V, Weaver JU, Razvi S. The Natural
History of Subclinical Hyper- thyroidism in Graves’ Disease:
The Rule of Thirds. Thyroid.
2016 Jun. 26(6):765-9. DOI: 1 0
. 1
0 8
9 / thy.2015.0470. Available from: https://
pubmed.ncbi.nlm.nih.gov/27090092/
7. Davies T, Andersen S, Latif
R, Nagayama Y, Barbesino G, Brito M
et al. Graves’ disease. Nature Reviews Di- sease
Primers. 2020 Jul 2; 6 (1). DOI: 10.1038/s41572- 020- 0184-y. Available from: https://pubmed.ncbi.nlm.nih. gov/32616746/
8.
Smith TJ, Hegedus L. Graves’ disease.
N Engl J Med. 2016;375:1552–65. DOI:
10.1056/NEJMra1510030. Available from: https://www.nejm.org/doi/full/10.1056/ nejmra1510030
9. Freitas, Maria., Albuquerque,
Luciano, et all. Diagnós- tico e
tratamento da doença de Graves. Endocrinologia
Clínica, 7ª Edição 2021. Lucio Vilar.(pp 555- 585) ISBN: 9788527736664. Disponible en:
https://loja.ibcmed.com/ produto/endocrinologia-clinica- 7a-edicao-2021-2/
10. Ross DS, Burch HB, Cooper
DS, et al. 2016 American Thyroid
Association Guidelines for Diagnosis and Mana-
gement of Hyperthyroidism and Other Causes of Thyro- toxicosis. Thyroid. 2016 Oct. 26
(10):1343-1421. DOI: 10.1089/thy.2016.0229.
Available from: https://pubmed. ncbi.nlm.nih.gov/27521067/
11. Nguyen CT, Sasso EB, Barton L, Mestman
JH. Graves’ hyperthyroidism in pregnancy: a clinical review.
Clin Dia- betes
Endocrinol. 2018. Mar 1;4:4. DOI 10.1186/s40842- 018- 0054-7. Available from:
https://pubmed.ncbi.nlm.nih. gov/29507751/
12. Alexander EK. et al. 2017 guidelines of the Ame- rican Thyroid Association for the
diagnosis and mana- gement of thyroid
disease during pregnancy and the pos- tpartum.
Thyroid. 2017 Mar; 27(3):315-389. DOI: 10.1089/ thy.2016.0457.
Available from: https://pubmed.ncbi.nlm. nih.gov/28056690/
13. Chen Y, Wu X, Wu R, Sun X,
Yang B, Wang Y, et al. Changes in profile of
lipids and adipokines in patients with
newly diagnosed hypothyroidism and hyperthyroi- dism. Scientific Reports.
2016; 6. 26174. DOI: 10.1038/
srep26174. Available from: https://www.nature.com/arti- cles/srep26174
14. Bode H, Ivens B, Bschor T,
Schwarzer G, Henssler J, Baethge C. Hyperthyroidism and clinical depression: a
sys tematic review and meta-analysis. Translational Psychiatry. 2022; 12. 362.
DOI: 10.1038/s41398-022-02121-7. Avai lable from: https://www.nature.com/articles/s41398-022- 02121-7
15. Jabbar A, Pingitore A,
Pearce S, Zaman A, Lervasi G, Razvi S. Thyroid hormones and cardiovascular
disease. Nature Rviews. Cardiology. 14, 39–55 (2017). DOI:
10.1038/nrcardio.2016.174. Available f r o m : https://www.nature.com/articles/nrcardio.2016.174
16. Lakho M, Magsi A, Lakho S,
Ali M, Bhanbhro F, Magsi S. Frequency of Hyperthyroidism in Hypokalemic
Periodic Paralysis. Pakistan Journal of Medical and Health Sciences. 2022.
16(6): 353-354. DOI 10.53350/pjmhs22166353. Available from:
https://pjmhsonline.com/index.php/pjmhs/ article/view/1599
17. Alqahtani HA, Almagsoodi
AA, Alshamrani ND, Almalki TJ, Sumaili AM. Common Electrolyte and Metabolic Ab-
normalities Among Thyroid Patients. Cureus. 2021 May 30;13(5): e15338. DOI:
10.7759/cureus.15338. eCollection 2021 May. PMID: 34235017 Available from: https://www.
ncbi.nlm.nih.gov/pmc/articles/PMC8241464/
18. Tun NN, Beckett G, Zammitt
NN, Strachan MW, Seckl JR, Gibb FW. Thyrotropin Receptor Antibody Levels at
Diagnosis and After Thionamide Course Predict Graves’ Di- sease Relapse.
Thyroid. 2016 Aug. 26 (8):1004-1009. DOI: 10.1089/thy.2016.0017. Available
from: https://pubmed. ncbi.nlm.nih.gov/27266892/
19. Blick C, Nguyen M, Jialal
I. Thyrotoxicosis. 2022 Jul 5. Avaialble from: StatPearls. Treasure Island
(FL): StatPearls Publishing; 2022 Jan. PMID: 29489233. Available from: https://www.ncbi.nlm.nih.gov/books/NBK482216/
20. Kahaly GJ, Bartalena L,
Hegedüs L, et al. Euro- pean Thyroid Association Guideline for the Manage- ment of Graves’
Hyperthyroidism. Eur Thyroid J. 2018 Aug;7(4):167-186. doi: 10.1159/000490384.
Epub 2018 Jul. PMID: 30283735; PMCID: PMC6140607. Available from:
https://etj.bioscientifica.com/view/journals/etj/7/4/ ETJ490384.xml
21. Sharma A, Stan MN.
Thyrotoxicosis: Diagnosis and Ma- nagement. Mayo Clin Proc. 2019
Jun;94(6):1048-1064. Available from: https://www.mayoclinicproceedings.
org/article/S0025-6196(18)30799-7/fulltext
22. Varadharajan K, Choudhury
N. A systematic review of the incidence of thyroid carcinoma in patients under-
going thyroidectomy for thyrotoxicosis. Clin Otolary- ngol. 2020. Jul; 45(4): 538-544. Epub 2020 Apr 20. PMID:
32149464. Available from: https://onlinelibrary.wiley.com/
doi/10.1111/coa.13527
23. Roque, Catarina & Sousa
Santos, Francisco & Pilli, Tania & Dalmazio, Gilda & Castagna,
Maria & Pacini, Furio. Long-term Effects of Radioiodine in Toxic Multinodular Goiter:
Thyroid Volume, Function, and Autoimmunity. The Journal of Clinical
Endocrinology & Metabolism. 2020 Jul 1; 105(7):dgaa214. Available from:
https://academic.oup. com/jcem/article/105/7/e2464/5823841?login=false